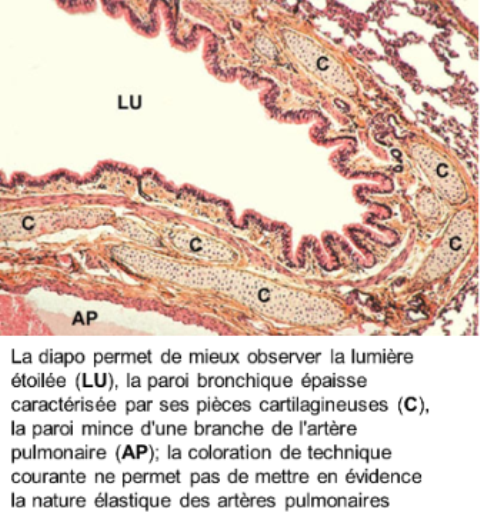
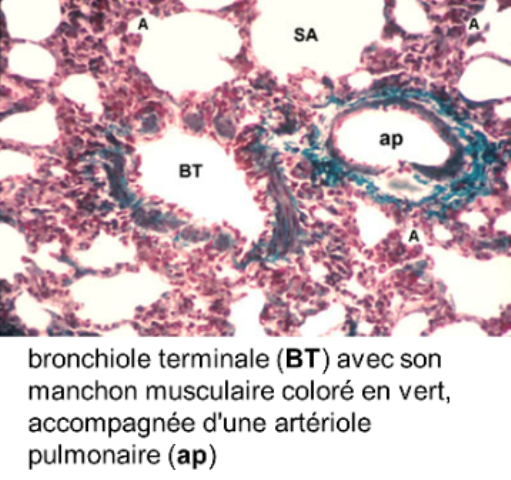
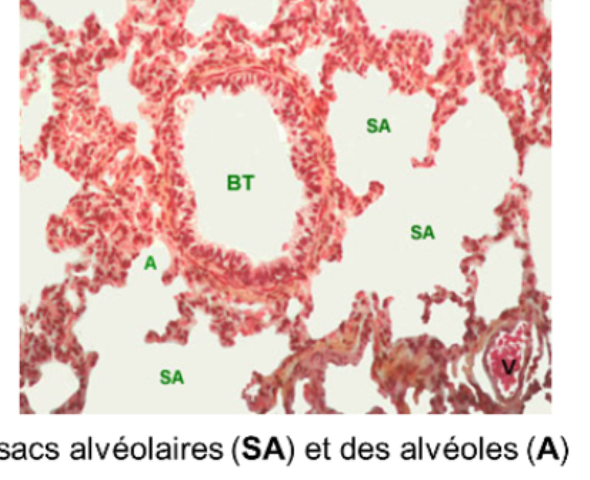
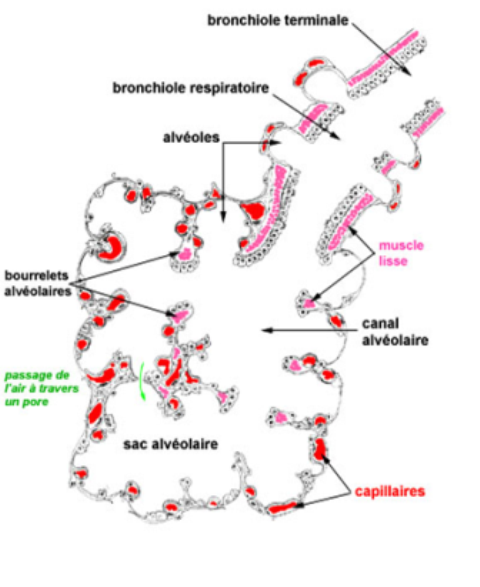
Objectif:
INTRODUCTION
L'appareil respiratoire a un rôle essentiel dans l'hématose :
il apporte l'oxygène au sang qui le distribue dans tout l'organisme et rejette le gaz carbonique.
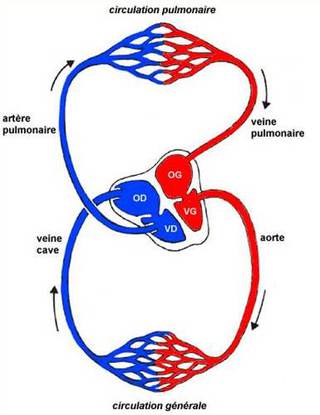
il existe deux systèmes circulatoires sanguins
La grande circulation ou circulation générale où le sang oxygéné part du ventricule gauche du cœur par l'aorte et irrigue tous les tissus de l'organisme dont il revient, chargé de gaz carbonique, par la veine cave jusqu'à l'oreillette droite;
la petite circulation ou circulation pulmonaire où le sang chargé de gaz carbonique part du ventricule droit par l'artère pulmonaire, se libère du gaz carbonique et s'enrichit en oxygène dans le parenchyme pulmonaire, et retourne à l'oreillette gauche par la veine respiratoire.
il participe à la défense de l'organisme par la présence de follicules et de tissu lymphoïde diffus disséminés dans ses muqueuses => il appartient au Tissu Lymphoïde Associé aux Muqueuses ( MALT )
il contient des cellules endocrines sécrétant des amines et des polypeptides ayant une activité hormonale ou de neurotransmetteur (sérotonine, bombésine, calcitonine, enképhaline); il fait partie du Système Endocrinien Diffus (SED) au même titre que le tractus gastro-intestinal et le tractus génito-urinaire.
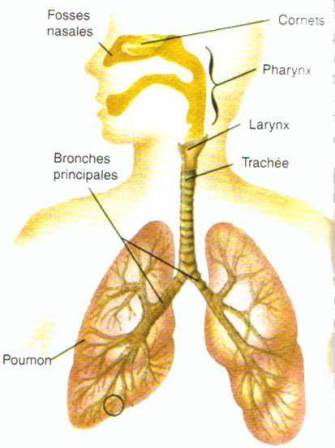
LE SYSTÈME RESPIRATOIRE
Le système respiratoire comprend :
le nez,
le pharynx (la gorge),
le larynx (boîte vocale),
la trachée,
les bronches
et les poumons
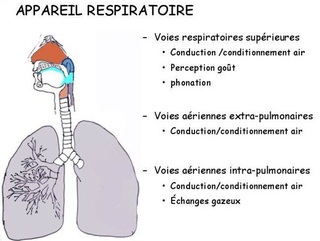
Les voies respiratoires supérieures comprennent:
le nez,
le pharynx
et les structures associées à ces parties du corps.
Les voies respiratoires inférieures comprennent:
le larynx,
la trachée,
les bronches
et les poumons
Sur le plan fonctionnel, le système respiratoire se divise en deux grandes zones :
La Zone de conductrice consiste en un système de cavités et de tubes interreliés (nez, pharynx, larynx, trachée, bronches et bronchioles) qui conduisent l'air dans les poumons.
La Zone respiratoire est constituée des parties du système respiratoire où s'effectuent les échanges gazeux (bronchioles respiratoires, canaux alvéolaires et alvéoles).
LES VOIES AÉRIENNES SUPÉRIEURS
- les fosses nasales,
- le nasopharynx,
- le larynx,
- la trachée et le début des deux bronches souches
- les voies aérophores intrapulmonaires transportant l'air dans le parenchyme pulmonaire depuis les bronches souches jusqu'aux bronchioles terminales
L'appareil respiratoire comprend le parenchyme respiratoire, assurant l'hématose, débutant par les bronchioles respiratoires et s'achevant au niveau de millions d'alvéoles pulmonaires.
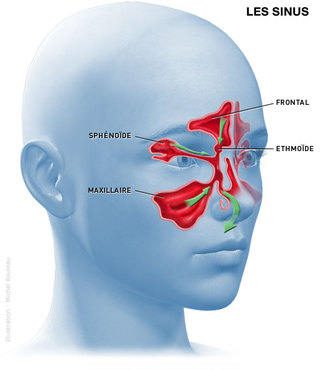
LE NEZ & LES FOSSES NASALES
ANATOMIE
Le nez comprend une partie externe et une partie interne à l'intérieur du crâne.
Les canaux lacrymo- nasaux et ceux des sinus paranasaux (frontal, sphénoïdal, maxillaire et ethmoïdal) débouchent également dans la partie interne du nez.
-
l'ethmoïde (qui forme également le toit),
-
les maxillaires,
-
les lacrymaux,
-
les palatins
-
et les cornets inférieurs du nez.
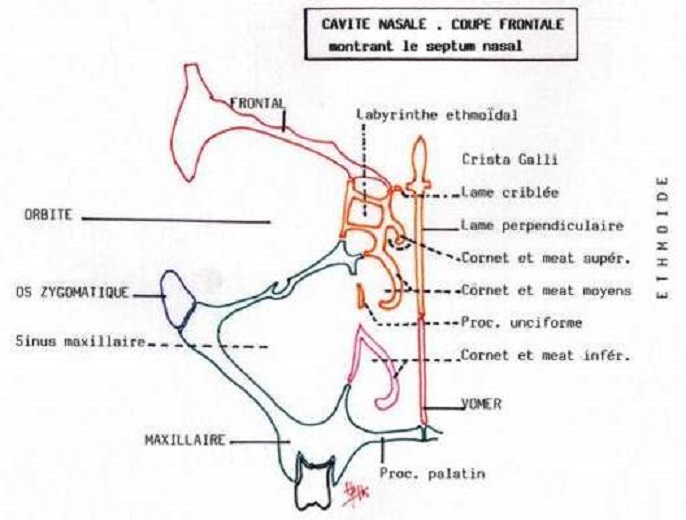
Au nombre de deux, séparées par la cloison nasale et situées au niveau de la face, elles constituent l’orifice supérieur de l’appareil respiratoire.
Elles commencent au niveau de l’orifice narinaire, se poursuivent par le vestibule (situé sous les ailes du nez) puis par les fosses nasales proprement dites, pour se terminer au niveau des choanes.
Classiquement, on leur associe les sinus qui sont des cavités pneumatiques creusées dans les os de la face :
- S.Maxillaires, creusés dans le corps du maxillaire se projetant de part et d’autre des ailes du nez
- Cellules ethmoïdales (ou labyrinthe), dans l’épaisseur des masses latérales de l’ethmoïde
- S.Frontaux, dans l’écaille du frontal, au dessus des arcades
- S.Sphénoïdaux, dans le corps du sphénoïde
Ces sinus s’abouchent dans les fosses nasales au niveau des méats, situés sous des replis des parois latérales appelés cornets.
Le reste est formé par:
le vomer,
la lame perpendiculaire de l'ethmoïde,
les maxillaires
et les os palatins .
La portion antérieure des cavités nasales, tout juste à l'intérieur des narines, est le vestibule ; il est entouré de cartilage.
La portion supérieure des cavités nasales est entourée d'os.
Les structures internes du nez ont 3 fonctions spécialisées :
- elles réchauffent, humidifient et filtrent l'air qui pénètre dans le nez ;
- elles reçoivent les stimuli olfactifs ;
- elles procurent des caisses de résonance grandes et creuses qui modifient le timbre de la voix.
Lorsque l'air pénètre dans les narines, il traverse d'abord le vestibule.
Ce vestibule est tapissé de peau contenant des poils grossiers qui filtrent les grosses particules de poussière.
L'air passe ensuite dans la région supérieure des cavités nasales.
Trois étages, formés par les prolongements des cornets supérieur, moyen et inférieur, font saillie à partir de la paroi latérale des cavités nasales.
Les cornets, qui atteignent presque la cloison nasale, divisent les cavités nasales en une série de sillons, les méats supérieur, moyen et inférieur.
Une membrane muqueuse tapisse les cavités nasales et les étages formés par les cornets.
Les récepteurs olfactifs se trouvent dans I' épithélium olfactif, au niveau de cette partie de la muqueuse olfactive qui tapisse les cornets supérieurs et la cloison adjacente.
Au-dessous de cette région, la muqueuse contient des capillaires et des cellules cylindriques ciliées pseudostratifiées et de nombreuses cellules caliciformes.
En circulant autour des cornets et des méats, l'air est réchauffé par le sang des capillaires.
Le mucus sécrété par les cellules caliciformes humidifie l'air et retient les particules de poussière.
Le liquide drainé par les canaux lacrymo-nasaux et, peut-être, les sécrétions en provenance des sinus para nasaux aident également à humidifier l'air.
Les cils déplacent les amas de mucus et de poussière vers le pharynx, afin qu'ils soient éliminés des voies respiratoires par la déglutition ou l'expectoration (crachement).
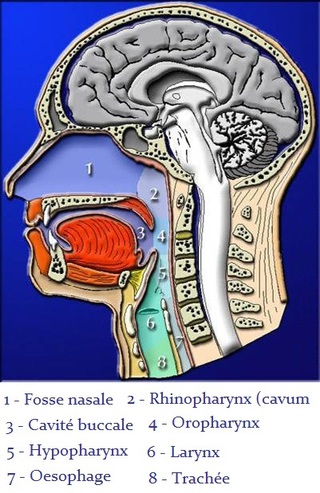
2. Le Pharynx
La portion moyenne du pharynx, l'oropharynx, se trouve derrière la cavité buccale ; elle s'étend du palais mou jusqu'au niveau de l'os hyoïde.
L'oropharynx ne contient qu'une ouverture, le gosier, l'ouverture de la bouche.
Il est tapissé d'un épithélium pavimenteux.
Cette partie joue un rôle dans la respiration et dans la digestion, puisqu'elle sert de passage à l'air, aux aliments et aux boissons.
Il mesure 13 cm de long environ, et s'étend des narines internes (choanes) jusqu'au niveau du cartilage cricoïde.
Sa paroi est composée de muscles squelettiques et est délimitée par une muqueuse.
Le pharynx sert de conduit permettant le passage de l'air et de la nourriture, et constitue une caisse de résonance pour la phonation.
La partie la plus élevée du pharynx, le nasopharynx, se trouve derrière la partie interne du nez et elle s'étend jusqu'au niveau du voile du palais (palais mou).
Sa paroi comprend quatre ouvertures : deux narines internes (choanes) et deux ouvertures menant aux trompes d'Eustache.
Le nasopharynx échange également de petites quantités d'air avec les trompes d'Eustache, de façon à équilibrer la pression de l'air entre l'oreille, le nez et la gorge.
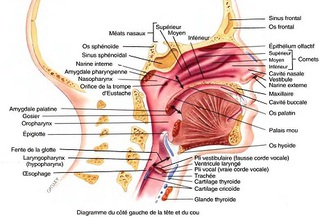
le pharynx comprend de nombreuses formations lymphoïdes dessinant l'anneau de Waldeyer.
- Avec l'amygdale linguale située à la base postérieure de la langue.
- Les amygdales pharyngées dans la partie supérieure du nasopharynx (arrière fond des fosses nasales).
- Les amygdales palatines (les plus volumineuses et les plus importantes) de part et d'autre de la luette.
- Les amygdales tubaires autour des orifices de la trompe d'Eustache.
Il est tapissé d'un épithélium cylindrique pseudostratifié cilié; les cils déplacent le mucus en direction de la partie la plus inférieure du pharynx.
La portion moyenne du pharynx, l'oropharynx, se trouve derrière la cavité buccale ; elle s'étend du palais mou jusqu'au niveau de l'os hyoïde.
L'oropharynx ne contient qu'une ouverture, le gosier, l'ouverture de la bouche.
Il est tapissé d'un épithélium pavimenteux.
Cette partie joue un rôle dans la respiration et dans la digestion, puisqu'elle sert de passage à l'air, aux aliments et aux boissons.
La région inférieure du pharynx, le laryngopharynx, s'étend vers le bas à partir de l'os hyoïde et se continue avec l'œsophage (conduit servant au passage des aliments),vers l'arrière, et avec le larynx, vers l'avant.
Tout comme . l'oropharynx, le laryngopharynx constitue une voie respiratoire et digestive, et il est tapissé d'un épithélium pavimenteux stratifié.
3- Le Larynx
Le larynx situé en avant de l‘ œsophage contient l'épiglotte, sorte de valve empêchant la pénétration des aliments dans la trachée.
Le larynx possède un squelette cartilagineux complexe et est tapissé par une muqueuse respiratoire, sauf au niveau des cordes vocales inférieures ou cordes vocales vraies.
Ces dernières comportent un:
- épithélium épidermoïde,
- des fibres élastiques
- et des fibres musculaires striées (le muscle vocal) et constituent l'organe de la phonation.
Le larynx est un court passage reliant le pharynx à la trachée.
Il est situé dans la partie médiane du cou, en avant des quatrième, cinquième et sixième vertèbres cervicales (C4-C6).
La paroi du larynx est soutenue par neuf pièces de cartilage, trois paires et trois impaires.
Les trois pièces impaires sont:
- le cartilage thyroïde,
- l'épiglotte
- et le cartilage cricoïde.
Parmi les cartilages pairs,
- les cartilages aryténoïdes sont les plus importants, étant donné qu'ils influencent la position et la tension des cordes vocales.
- Les cartilages corniculés et cunéiformes jouent un rôle moins important.
L'épiglotte (epi: au-dessus; glotta: langue):
C'est une grosse pièce de cartilage élastique en forme de feuille.
La «tige» de l'épiglotte est attachée au bord antérieur du cartilage thyroïde, mais la « feuille » elle-même n'est pas attachée ; elle peut donc se déplacer de haut en bas, comme une trappe.
Durant la déglutition, le larynx se soulève ; la partie libre de l'épiglotte se rabat alors sur la glotte et la ferme. La glotte est formée d'une paire de replis muqueux, les plis vocaux ou vraies cordes vocales et d'un espace (fente de la glotte) situé entre les cordes vocales.
De cette façon, le larynx peut se refermer, et les liquides et solides (aliments) sont dirigés dans l'œsophage et ne peuvent pénétrer dans le larynx et dans les voies respiratoires situées au-dessous de celui-ci.
Lorsqu'un corps étranger pénètre dans le larynx, un réflexe de toux se manifeste afin de l'expulser.
La phonation
La membrane muqueuse du larynx comprend deux paires de replis :
- une paire supérieure, les plis vestibulaires (fausses cordes vocales),
- et une paire inférieure, les plis vocaux (vraies cordes vocales).
L'espace entre les plis vestibulaires est la fente vestibulaire.
Le ventricule laryngé est un prolongement latéral de la partie médiane de la cavité laryngienne situé entre les plis vestibulaires, au-dessus, et les plis vocaux, au-dessous.
Lorsque les plis vestibulaires sont réunis, ils permettent de retenir la respiration contre la pression qui se trouve dans la cavité thoracique (comme lorsque l'on fait un effort pour soulever un objet lourd).
La membrane muqueuse des cordes vocales est tapissée d'un épithélium pavimenteux stratifié non kératinisé.
Sous la membrane se trouvent des bandes de ligaments élastiques étirées entre des pièces de cartilage rigide, comme les cordes d'une guitare.
Les muscles squelettiques du larynx, appelés muscles intrinsèques, sont attachés aux pièces de cartilage rigides et aux cordes vocales elles-mêmes.
Lorsque les muscles se contractent, ils exercent une traction sur les ligaments élastiques et étirent les cordes vocales dans les voies respiratoires ; la glotte se trouve donc rétrécie.
Lorsque l'air est dirigé vers les vraies cordes vocales, celles-ci vibrent et produisent des ondes sonores dans la colonne d'air du pharynx, du nez et de la bouche.
Plus la pression de l'air est forte, plus le son est intense.
LES VOIES AEROPHORES INTRAPULMONAIRES
La Trachée
C’est un conduit tubulaire rigide de 10 à 12 cm de long sur 2 cm de diamètre qui chemine à la face antérieure du cou avant de s'enfoncer dans la partie supérieure du médiastin où elle se divise en deux branches, les bronches souches.
La paroi trachéale est formée de trois couches, une muqueuse, une tunique fibrocartilagineuse et une adventice :
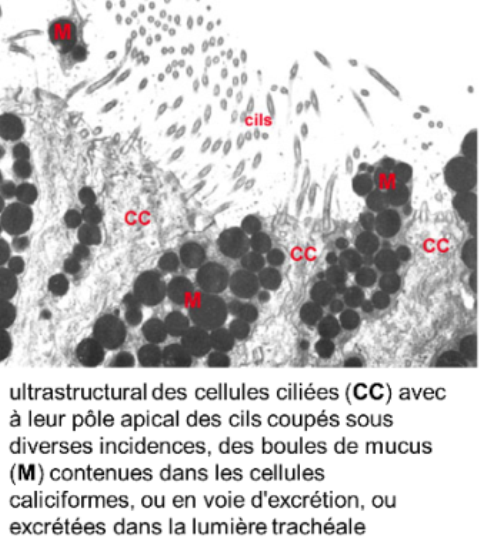
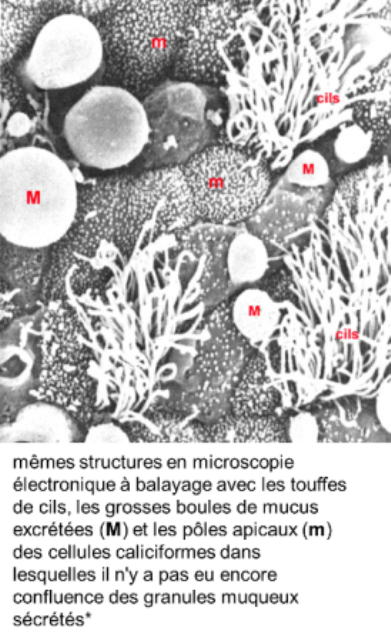
la muqueuse:
De type respiratoire, comporte
- un épithélium pseudostratifié avec des cellules ciliées,
- des cellules caliciformes sécrétant du mucus,
- des cellules basales de remplacement
- et des cellules endocrines (mises en évidence par des techniques d'immunocytochimie);
Le chorion est:
conjonctivo-élastique, riche en glandes mixtes à prédominance muqueuse (plus nombreuses dans la région postérieure) et en tissu lymphoïde diffus ou nodulaire; la vascularisation y est abondante
la tunique fibrocartilagineuse:
Est caractérisée par la présence de 15 à 20 anneaux incomplets en fer à cheval, les arceaux cartilagineux*, dont les extrémités postérieures sont reliées par des faisceaux de fibres musculaires lisses formant le muscle trachéal entouré de tissu conjonctif dense riche en fibres élastiques;
entre les arceaux cartilagineux, la tunique moyenne est faite de tissu conjonctif fibro-élastique
l'adventice:
Est classique, conjonctivo-adipeuse, riche en vaisseaux et en nerfs
Les fibres nerveuses traversent toute la paroi;
Elles proviennent essentiellement du système nerveux végétatif : les fibres parasympathiques (pneumogastrique = nerf vague) stimulent la sécrétion glandulaire et la contraction musculaire, à l'inverse des fibres sympathiques qui provoquent le relâchement musculaire
La muqueuse trachéale réchauffe (rôle des vaisseaux sanguins), humidifie (sécrétion aqueuse des glandes séreuses) et épure l'air inspiré des poussières, bactéries et virus;
La Trachée cette épuration met en jeu trois mécanismes :
- le 1er est la capture et le rejet des particules piégées par le film mucociliaire recouvrant l'épithélium et fonctionnant comme un tapis roulant, à la vitesse de 1cm/minute, en direction du pharynx où elles sont expectorées ou le plus souvent avalées (dans les conditions normales);
- le 2éme mécanisme est la production de lysozyme (enzyme bactéricide) par les cellules séreuses des glandes mixtes du chorion;
- le 3ème mécanisme de défense est la sécrétion d'anticorps, spécialement des IgA par les lymphocytes B et les plasmocytes des structures lymphoïdes contenues dans le chorion, en quantité plus ou moins grande selon la qualité de l'air inspiré.
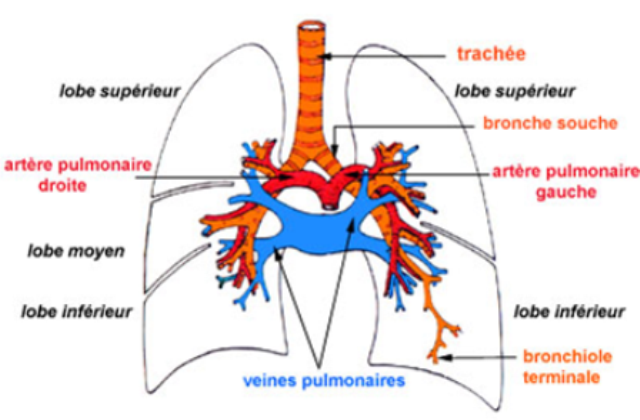
Les poumons
Ils sont contenus dans la cage thoracique limitée sur sa face inférieure par le diaphragme; ils peuvent être comparés à deux sacs spongieux mobiles appendus et fixés au niveau du hile pulmonaire*(* le hile pulmonaire est le point d'arrivée de la bronche souche, de l'artère pulmonaire et d'autres vaisseaux; il est formé de tissu conjonctivo-élastique assurant avec la plèvre et les formations conjonctivo-élastiques intrapulmonaires un système de tension permettant les variations de volume du poumon adaptées aux mouvements respiratoires).
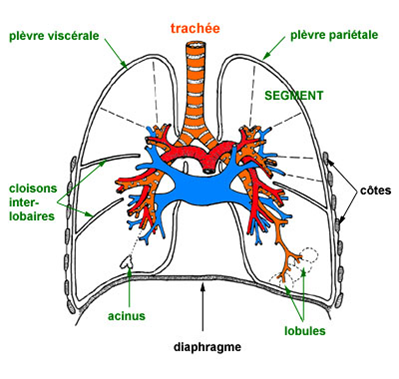
Entourés par la plèvre, ils sont constitués de: 3 lobes pour le poumon droit : lobe supérieur, lobe moyen, lobe inférieur, 2 lobes pour le poumon gauche : lobe supérieur et lobe inférieur; ces lobes sont délimités par des cloisons conjonctivo-élastiques, expansions internes de la plèvre viscérale.
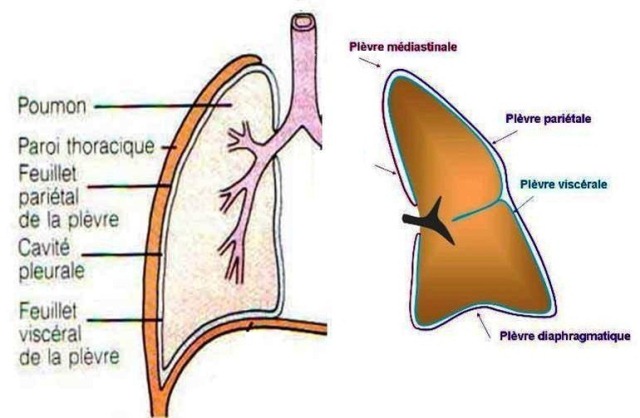
La plèvre
Deux feuillets de membrane séreuse, collectivement appelés membrane pleurale, entourent et protègent chacun des poumons .
Le feuillet externe, appelé plèvre pariétale, est attaché à la paroi de la cavité thoracique.
Le feuillet interne, la plèvre viscérale, recouvre les poumons eux-mêmes.
Entre les plèvres viscérale et pariétale, un petit espace virtuel, la cavité pleurale, contient un liquide lubrifiant sécrété par les plèvres. Ce liquide empêche la friction entre les plèvres et permet à ces dernières de glisser l'une sur l'autre au cours de la respiration.
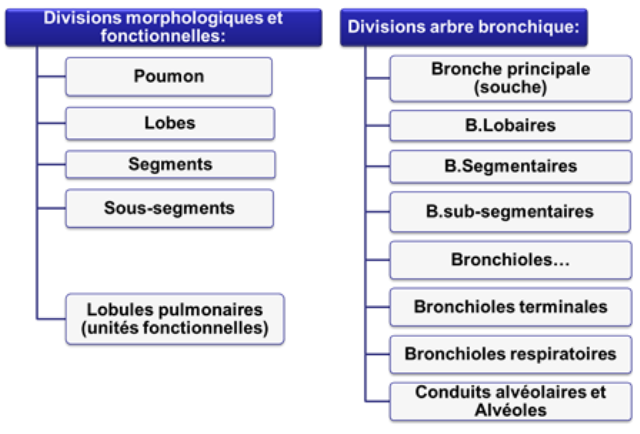
ORGANISATION MORPHOLOGIQUES
les lobes définis précédemment
les segments pulmonaires délimités par des plans fibreux (véritables plans de clivage permettant l'ablation de segments pathologiques):
le poumon droit en contient 10 avec:
- 3 segments dans le lobe supérieur,
- 2 dans le lobe moyen
- et 5 dans le lobe inférieur;
le poumon gauche en comporte 9 avec :
- 5 segments dans le lobe supérieur
- et 4 dans le lobe inférieur
les lobules:
individualisés par de fines cloisons conjonctivo-élastiques ou septa lobulaires;
ils sont en forme de pyramides tronquées de 2 à 2,5 cm;
la lobulation est plus nette chez le fœtus que chez l'adulte.
les acinus:
sont des unités morphofonctionnelles qui seront étudiées avec le parenchyme respiratoire
Structure histologique
Les poumons comportent deux types d'éléments :
- les voies aérophores intra-pulmonaires
- le parenchyme respiratoire
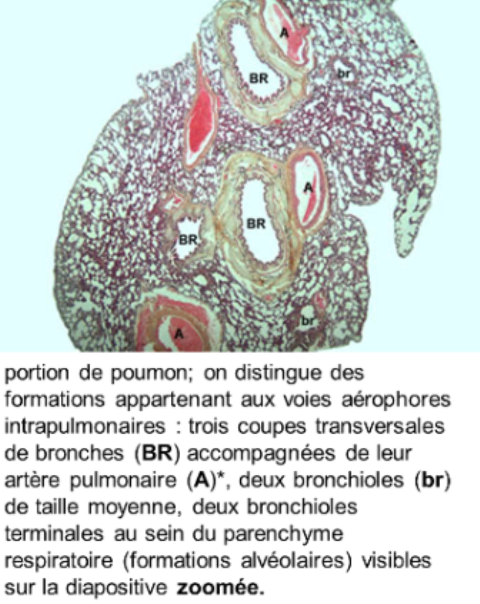
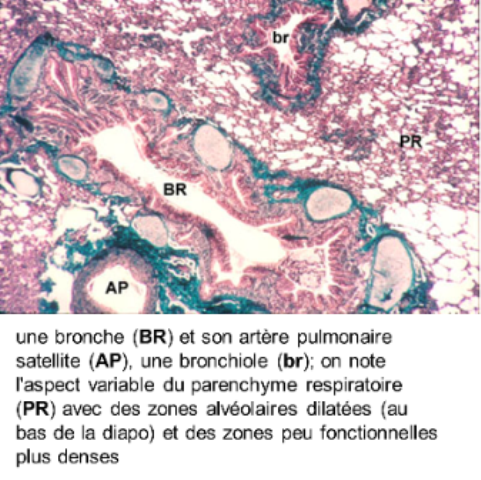
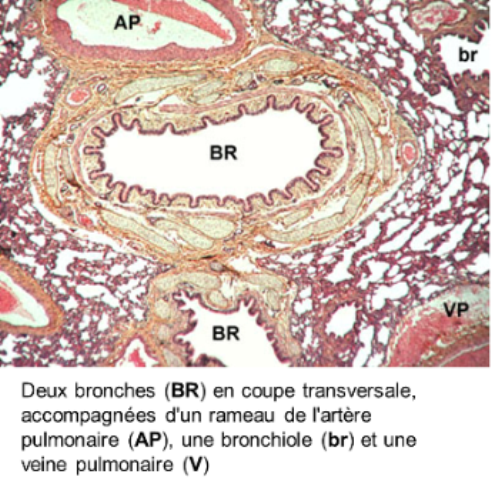
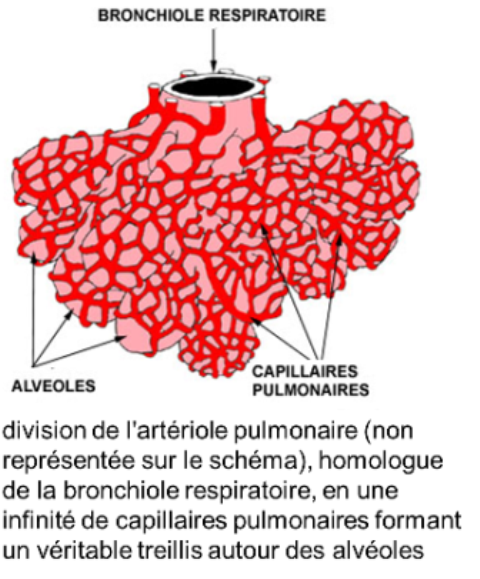
* l'artère pulmonaire est caractérisée par une paroi mince essentiellement conjonctivo-élastique, avec des fibres musculaires peu nombreuses : sa structure, très comparable à celle d'une veine, explique en partie la faible pression sanguine artérielle intrapulmonaire; l'artère pulmonaire bifurque en autant de branches que la bronche qu'elle accompagne : on emploie le terme d'artère satellite ou d'artère homologue.
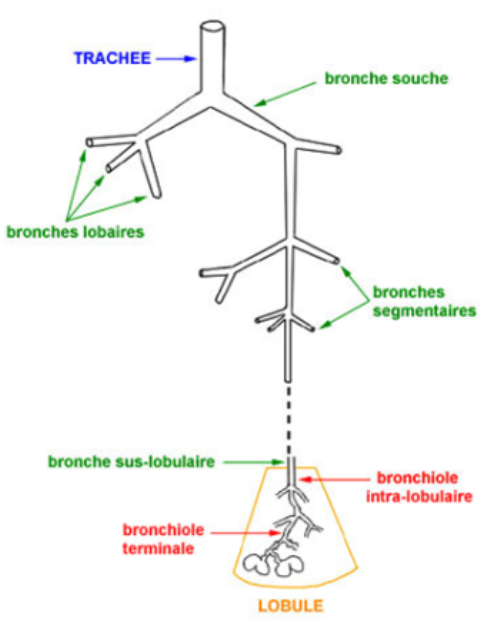
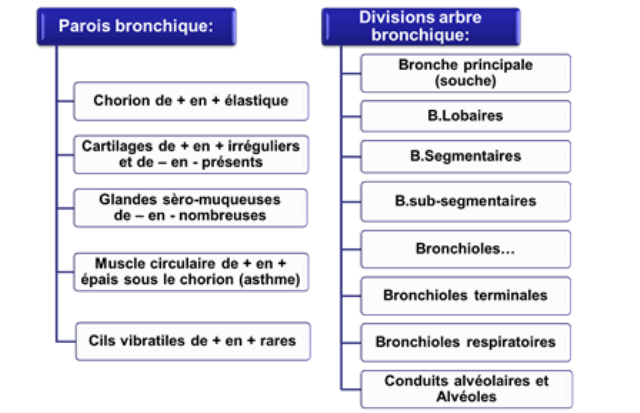
Les voies aérophores intra pulmonaires constituent l'arbre bronchique dont le "tronc" est la bronche souche (1,5cm de diamètre) et les "branches" sont de multiples ramifications (25 à 30) de plus en plus étroites de diamètre avec, comme derniers "rameaux", les bronchioles terminales (0,5mm de diamètre);
la branche souche droite et gauche, qui pénètrent dans chaque poumon au niveau du hile;
des bronches souches naissent immédiatement les bronches lobaires ou bronches secondaires se rendant dans chaque lobe du poumon (de la bronche souche droite 3 bronches lobaires et de la bronche souche gauche seulement 2);
la bronche lobaire se ramifie ensuite en un certain nombre de bronches segmentaires ou tertiaires;
les bronches tertiaires donnent naissance à des bronches de moins en moins grosses jusqu'aux bronches sus-lobulaires;
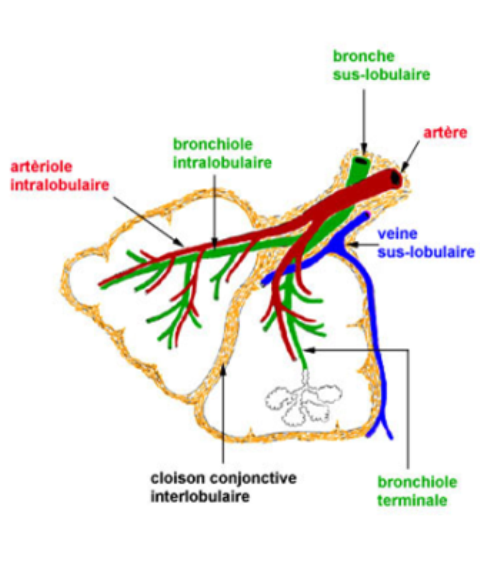
là se termine l'arbre bronchique au sens strict; dès sa pénétration dans le lobule, la bronche sus-lobulaire perd sa charpente cartilagineuse et devient la bronchiole intralobulaire
Deux lobules pulmonaires avec les ramifications de la bronchiole intralobulaire aboutissant aux bronchioles terminales qui, comme leur nom l'indique, marquent la fin des voies aérophores;
parallèlement l'artériole intralobulaire se divise (elle donnera naissance au réseau de capillaires pulmonaires); issues du réseau capillaire, les veinules se forment dans les cloisons interlobulaires.
Les bronches
les bronches souches extrapulmonaires sont identiques à la trachée, composées d'arceaux cartilagineux incomplets reliés par un muscle lisse postérieur
les bronches souches intrapulmonaires en diffèrent par la présence de plaques cartilagineuses irrégulières et d'un muscle spiralé circonférentiel
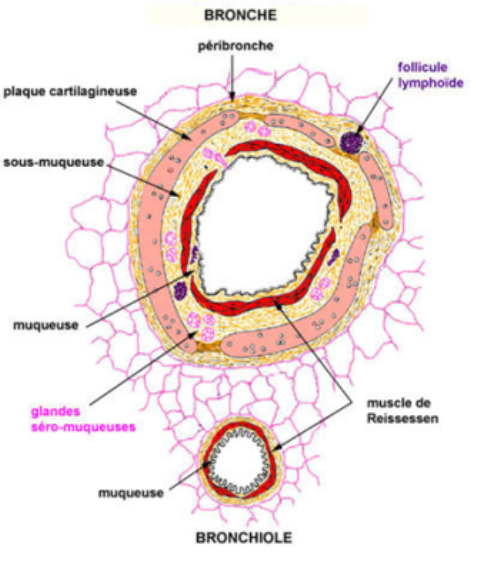
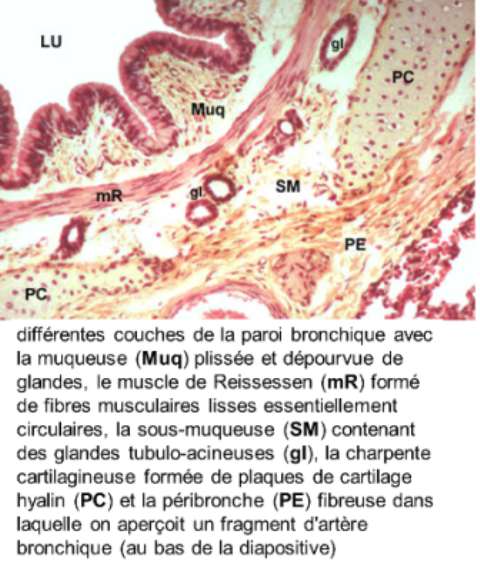
les bronches ont une structure de base identique:
- la lumière est étoilée
- la muqueuse est composée d'un épithélium de type trachéal mais d'un chorion dépourvu de glandes très riche en fibres et lames élastiques responsables des plis de la muqueuse; le chorion bien vascularisé comporte en outre du tissu lymphoïde diffus ou organisé en petits follicules; ces éléments sont d'autant plus nombreux que l'individu est exposé à un milieu aérien empoussiéré ou victime d'une infection bactérienne ou virale
- la musculeuse, couche circulaire discontinue, est formée de fibres musculaires lisses disposées en spirale, le muscle de Reissessen, permettant le raccourcissement et la contraction des bronches pendant l'expiration et leur relâchement pendant l'inspiration
- la sous-muqueuse contient des glandes tubulo-acineuses mixtes (séromuqueuses) s'ouvrant dans la lumière bronchique par de fins canaux excréteurs
- la charpente cartilagineuse est faite d'un empilement de plaques irrégulières circonférentielles de cartilage hyalin reliées entre elles par un tissu conjonctivo-élastique qui contient parfois des glandes à prédominance séreuse
- la péribronche ou gaine péribronchovasculaire, fusion des adventices de la bronche et de l'artère pulmonaire homologue, renferme les artère et veine bronchiques, des vaisseaux lymphatiques, des plexus nerveux et fibres amyéliniques d'origine sympathique et vagale; on y retrouve comme ailleurs des formations lymphoïdes.
Les artères bronchiques issues de l'aorte thoracique transportent du sang oxygéné et riche en nutriments aux poumons; les artères bronchiques irriguent les bronches et les cloisons conjonctives extralobulaires; elles ne pénètrent pas dans les lobules; les veines bronchiques n'existent qu'au niveau des grosses bronches, elles aboutissent à la veine cave; il existe donc deux types de circulation sanguine dans les poumons, la circulation fonctionnelle (artères et veines pulmonaires) qui assure l'hématose et la circulation systémique (artères et veines bronchiques) qui remplit son rôle trophique
- Au fur et à mesure de leurs ramifications, les bronches ont une lumière : de plus en plus festonnée (plis plus nombreux et plus marqués); l'épithélium devient moins haut et s'appauvrit en cellules caliciformes, le chorion s'amincit, la charpente cartilagineuse se réduit à quelques plages; le muscle spiralé de Reissessen forme une couche circulaire à peine ouverte pour laisser passer les quelques canaux excréteurs, la sous-muqueuse contient encore quelques glandes et se confond avec l'adventice puis avec le parenchyme pulmonaire avoisinant
cette couche devient proportionnellement de plus en plus épaisse par rapport aux autres couches de la paroi quand on se rapproche des ramifications distales de l'arbre bronchique
Les bronchioles
par définition, les bronchioles sont les bronches qui ont pénétré dans les lobules; elles diffèrent des petites bronches par :
- l'épithélium cylindrique simple dépourvu de cellules caliciformes, les cellules ciliées moins hautes et peu nombreuses; on voit apparaître un nouveau type cellulaire, les cellules de Clara ou cellules en dôme avec un pôle apical faisant saillie dans la lumière bronchiolaire caractérisé par la présence de quelques microvillosités irrégulières et de grains de sécrétion*
- le chorion très mince réduit à une fine lame élastique
- le muscle de Reissessen spiralé formant une couche circulaire fermée
- la disparition du cartilage
- la sous-muqueuse sans glandes se confondant avec l'adventice et le parenchyme pulmonaire.
cette couche devient proportionnellement de plus en plus épaisse par rapport aux autres couches de la paroi quand on se rapproche des ramifications distales de l'arbre bronchique
les bronchioles terminales (0,5mm de diamètre) sont les derniers conduits aérophores;
elles ont une lumière arrondie,
un épithélium cubique comportant de rares cellules ciliées éparpillées entre les cellules de Clara;
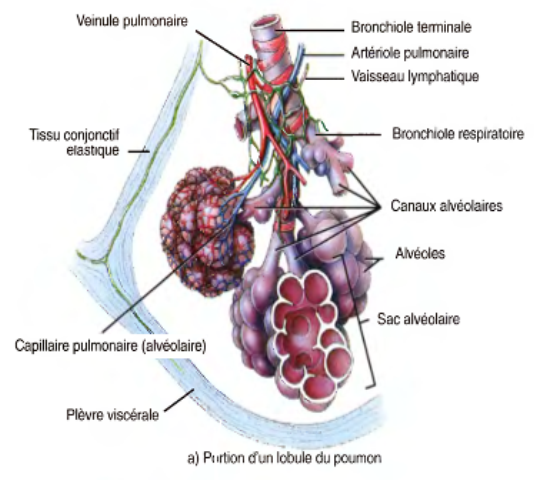
elles donnent naissance aux bronchioles respiratoires qui représentent les premiers éléments du parenchyme respiratoire
l'instabilité du muscle lisse des parois bronchiolaires provoque un spasme (contraction continue) obstruant les bronchioles; elle est responsable de l'asthme caractérisé par des épisodes de bronchoconstriction paroxystique; cliniquement la respiration est difficile (sensation d'étouffement), sifflante et accompagnée de toux; les facteurs étiologiques et déclenchants de l'asthme sont les réactions allergiques, les infections virales ou bactériennes, les changements brusques de température
Le parenchyme respiratoire
L'acinus pulmonaire
est l'unité morphofonctionnelle du parenchyme respiratoire;
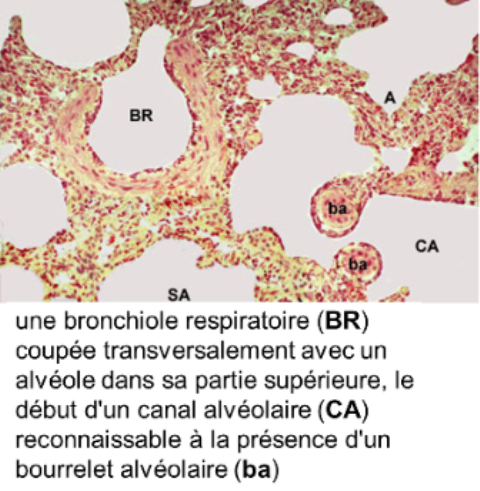
il est centré sur une bronchiole respiratoire qui se divise en quelques canaux alvéolaires;
chaque canal alvéolaire se poursuit par 2 ou 3 sacs alvéolaires dans lesquels s'ouvrent de multiples alvéoles;
la bronchiole respiratoire gère le fonctionnement de l'acinus pulmonaire qui est invalidé quand la lumière bronchiolaire est obstruée
Les bronchioles respiratoires
sont des segments courts qui ont la même structure histologique que les bronchioles terminales;
elles en diffèrent par la présence d'alvéoles pulmonaires s'ouvrant directement dans leur paroi,
ce qui fait qu'en plus de la conduction de l'air, elles sont impliquées dans les échanges gazeux qui s'effectuent au niveau des alvéoles
Les canaux alvéolaires,
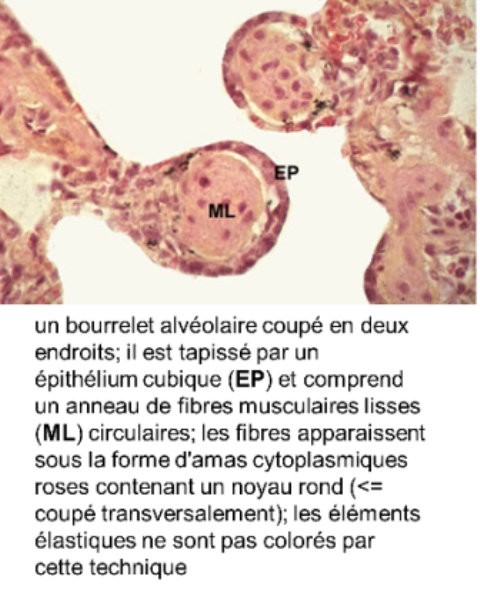
- larges et sinueux, n'ont pas de paroi propre : ils sont définis par les orifices des alvéoles et par les bourrelets alvéolaires; les bourrelets alvéolaires sont des épaississements annulaires comportant
- un épithélium cubique (cellules de Clara),
- des fibres élastiques
- des fibres musculaires lisses circulaires dans un interstitium conjonctif;
- le bourrelet alvéolaire est une sorte de sphincter dont la contraction ferme le territoire alvéolaire situé en aval
Les sacs alvéolaires
- sont la confluence de plusieurs alvéoles dont ils ont la structure
Les alvéoles pulmonaires,
chez l'Homme, sont de l'ordre de 300 millions;
leur surface est de 100 m² dont 60 à 80 sont le siège d'échanges gazeux entre l'air et le sang;
les alvéoles sont l'aboutissement des voies aériennes; ce sont des cavités plus ou moins polygonales de 0,1 à 0,3 mm de diamètre (diamètre variable au cours du cycle respiratoire);
ils s'ouvrent essentiellement dans les sacs alvéolaires, mais aussi dans les canaux alvéolaires et dans les bronchioles respiratoires;
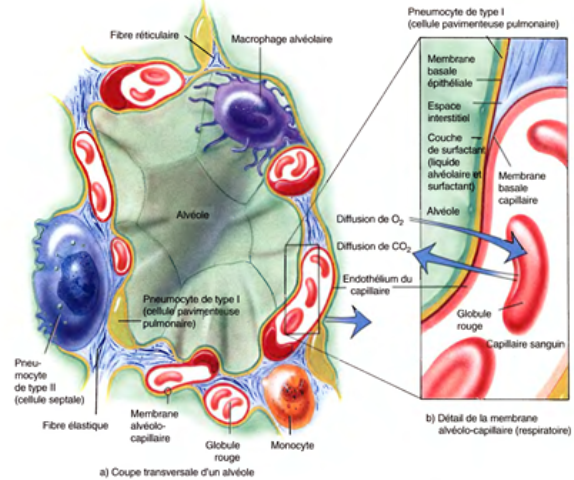
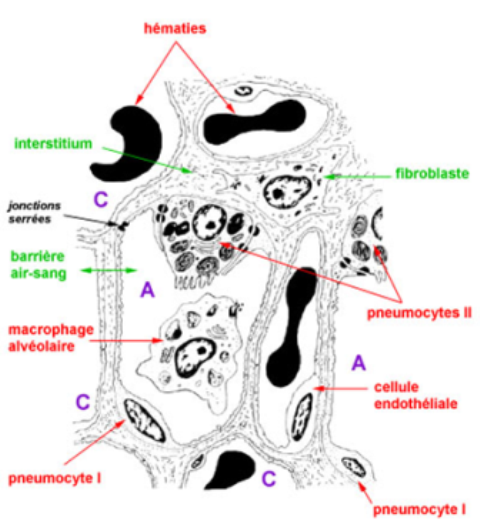
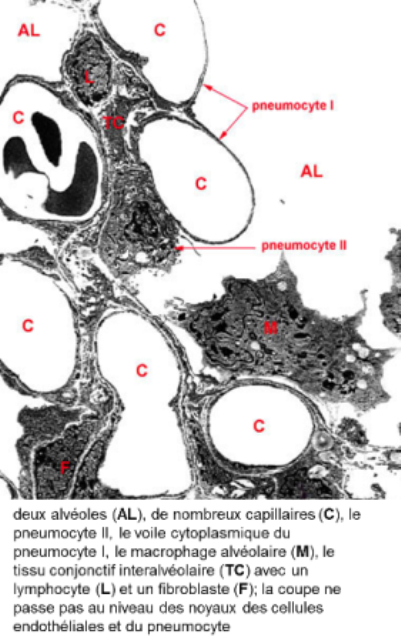
la paroi commune à deux alvéoles est la cloison interalvéolaire
la cloison interalvéolaire ou septum interalvéolaire comprend 3 constituants:
l'épithélium de surface forme un revêtement continu constitué de deux types de cellules réunies entre elles par des jonctions serrées (zonula occludens);
Le revêtement épithélial est continu sauf au niveau des pores de Kohn (de 8 nanomètres de diamètre) qui interrompent la cloison interalvéolaire dans sa totalité; leur existence permet la régularisation de la pression entre les alvéoles et un certain passage d'air entre des territoires voisins en cas d'obstruction bronchiolaire
Pneumocytes de type I:
(les pneumocytes membraneux ) sont de grandes cellules aplaties, de 0,2 à 0,5 micromètres d'épaisseur;
elles représentent 40 % de la population cellulaire mais recouvrent 90 % de la surface alvéolaire;
leur cytoplasme très étendu forme un voile très fin et leur noyau ovalaire foncé, allongé parallèlement à la membrane basale est rarement visible sur les coupes (rapport nucléo-cytoplasmique très faible) et il se confond volontiers avec le noyau des cellules endothéliales des capillaires;
seule la situation interne du noyau par rapport à la cloison interalvéolaire signe son origine épithéliale
Pneumocytes de type II:
(les pneumocytes granuleux)sont des cellules plus hautes, en forme de pyramide tronquée; elles sont les autres 60 %de la population mais recouvrent seulement 5 à 10 % de la surface alvéolaire;
ils sont situés le plus souvent aux bifurcations des septa interalvéolaires; les pneumocytes II ont un noyau central arrondi clair et un cytoplasme riche en grains de sécrétion; l'étude ultrastructurale montre de nombreuses microvillosités apicales, un appareil de Golgi et un réticulum endoplasmique développés et la présence de nombreux corps osmiophiles lamellaires composés de phospholipides et de protéines à l'origine du surfactant;;
le surfactant s'étale en un film tensio-actif, de 0,2 micromètres d'épaisseur, réduisant la tension superficielle, empêchant donc le collapsus des alvéoles lors de l'expiration; les pneumocytes de type II peuvent se dédifférencier et se multiplier pour donner naissance à des pneumocytes de type I en cas de lésion parenchymateuse d'origine inflammatoire ou infectieuse
l'interstitium septal est une fine couche conjonctive de soutien sous-épithéliale; elle est formée de quelques fibroblastes plus ou moins étoilés et de fibres de réticuline et d'élastine*
Les fibres élastiques sont un composant important de la paroi alvéolaire; l'élastine possède des propriétés remarquables d'extension et de contraction indispensables :
- aux changements de volume des poumons lors du cycle respiratoire
- à la rétraction des alvéoles permettant l'expulsion des gaz lors de l'expiration
- à la tension intrapulmonaire, rattachant les parties molles (bronchioles, canaux et sacs alvéolaires, alvéoles) d'une part aux bronches "rigidifiées" par leur squelette cartilagineux, d'autre part à la plèvre viscérale très élastique
les capillaires, de 7 à 10 micromètres de diamètre, sont de type continu, doublés de rares péricytes à l'extérieur de leur membrane basale; ils entourent les alvéoles à la manière de corbeilles et pénètrent dans les cloisons interalvéolaires
les cellules à poussière du parenchyme respiratoire sont des macrophages situés dans la cloison interalvéolaire ou dans la lumière de l'alvéole; ils sont issus des monocytes sanguins circulants; les macrophages complètent l'action d'épuration de l'air inpiré: (carbone ou bactéries)
les macrophages séjournent un temps variable dans le parenchyme respiratoire (certains y demeurent) puis ils sont soit véhiculés dans les vaisseaux lymphatiques jusqu'aux ganglions hilaires, soit entrainés par les gaz alvéolaires dans les bronchioles, les bronches et la trachée : englués dans le tapis muqueux, ils sont alors avalés ou expectorés au niveau du pharynx; d'autres cellules "inflammatoires" (polynucléaires, lymphocytes, plasmocytes, mastocytes) s'observent aussi dans le tissu conjonctif interalvéolaire; leur afflux dépend de l'état inflammatoire ou infectieux des poumons
les macrophages séjournent un temps variable dans le parenchyme respiratoire (certains y demeurent) puis ils sont soit véhiculés dans les vaisseaux lymphatiques jusqu'aux ganglions hilaires, soit entrainés par les gaz alvéolaires dans les bronchioles, les bronches et la trachée : englués dans le tapis muqueux, ils sont alors avalés ou expectorés au niveau du pharynx; d'autres cellules "inflammatoires" (polynucléaires, lymphocytes, plasmocytes, mastocytes) s'observent aussi dans le tissu conjonctif interalvéolaire; leur afflux dépend de l'état inflammatoire ou infectieux des poumons
Objectif:
INTRODUCTION
RÔLES
- Apport d’O2 et rejet de CO2
- Régulation du Ph
Mise en jeu de structure anatomiques précises :
- Système respiratoire
- Système circulatoire
2 zones à distinguer :
- Zone de conduction
- Zone respiratoire
Zone de conduction
Du nez aux bronchioles
- Nez, cavité nasale
- Pharynx, Larynx
- Trachée
- Bronches→ Bronchioles
Fonctions:
- Acheminer l’air
- Filtrer l’air
- Réchauffer l’air
- Humidifier l’air
Zone respiratoire
Fonctions:
- Echanges gazeux
- Bronchioles terminales
- Alvéoles et sacs alvéolaires
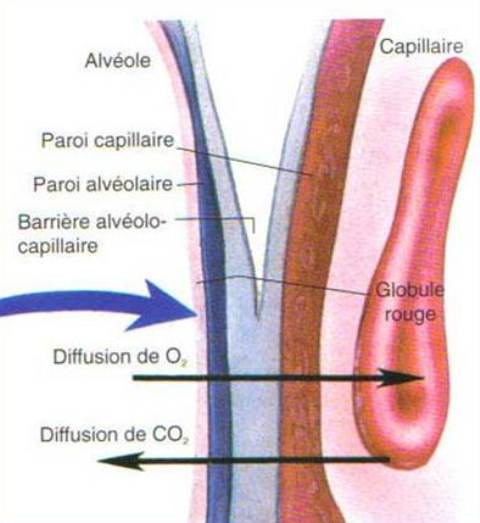
- Membrane alvéolo-capillaire :
- 3 couches constituent la MAC:
- La membrane alvéolaire
- Paroi capillaire
- Lame basale
MÉCANIQUE VENTILATOIRE
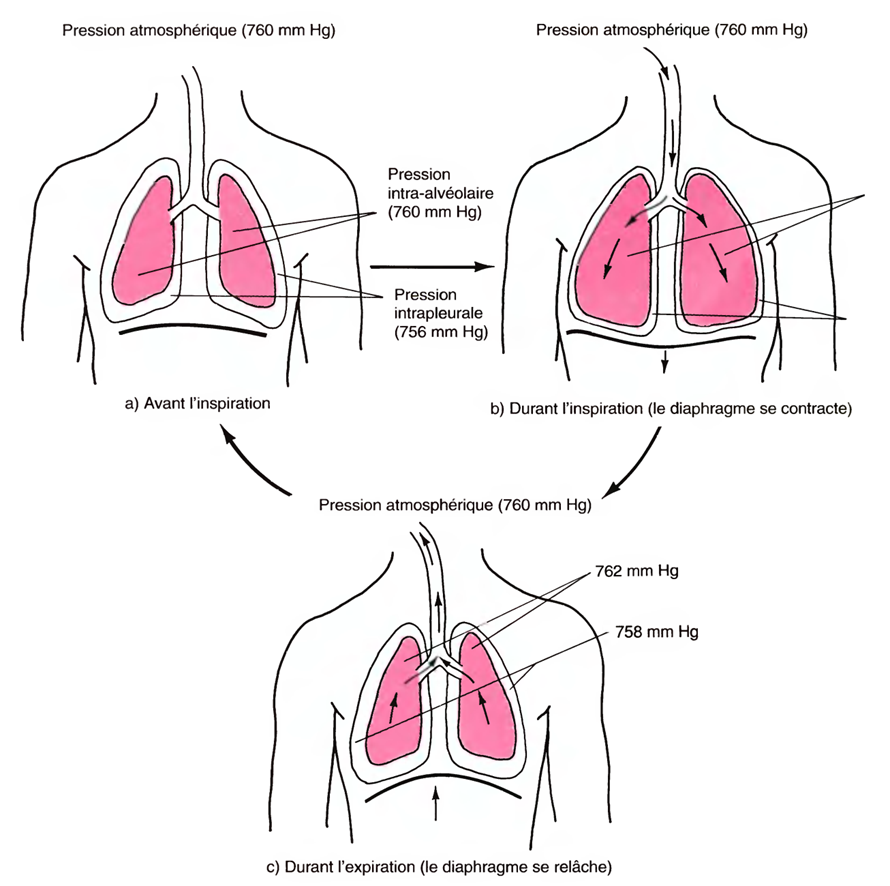
Le moteur des échanges gazeux entre les alvéoles et l'air ambiant (moteur de la ventilation), est constitué par les différences de pression qui existent entre ces deux milieux.
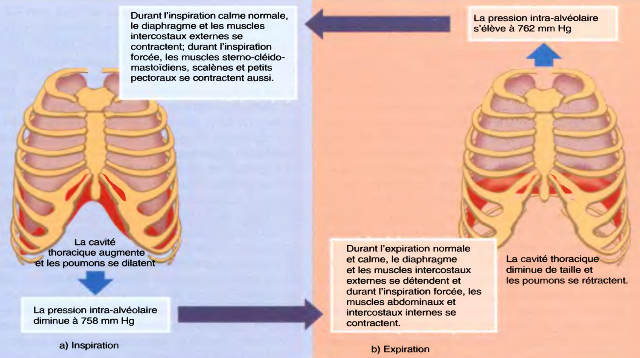
Lors de l'inspiration, la pression dans les alvéoles (pression intrapulmonaire) doit être inférieure à la pression (atmosphérique) de l'air ambiant ;
lors de l’expiration, c'est l'inverse qui doit se produire.
Si l'on suppose que…la pression atmosphérique est égale à zéro.
il s'ensuit que….pendant l'inspiration, la pression pulmonaire est négative et que, pendant l'expiration, elle est positive.
Pour atteindre ces pressions…le volume pulmonaire doit augmenter lors de l'inspiration et diminuer lors de l'expiration.
Ceci est assuré…d'une part, directement grâce aux mouvements du diaphragme,et, d'autre part, indirectement grâce aux autres muscles respiratoires qui agissent sur la cage thoracique (thorax).
Mécanique Ventilatoire
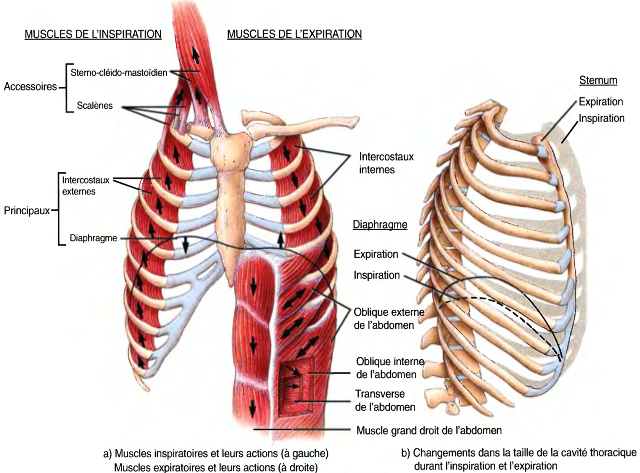
Les mécanismes intervenant au cours de l'inspiration sont :
- la contraction (aplatissement) du diaphragme :
- le soulèvement (augmentation) de la cage thoracique par contraction des muscles scalènes et des muscles intercostaux externes et
- le soulèvement de la cage thoracique par d'autres muscles accessoires.
Les mécanismes intervenant au cours de l'expiration sont :
- les mouvements des muscles de la paroi abdominale qui poussent le diaphragme vers le haut ;
- l'abaissement (diminution) de la cage thoracique, mouvement passif dû à la pesanteur et à l'élasticité
- la contraction des muscles intercostaux internes.
Poumon et Plèvre
Chaque poumon est recouvert de la plèvre
- Feuillet viscéral
- Feuillet pariétal
- Cavité pleurale
LES MUSCLES ET MOUVEMENTS RESPIRATOIRES
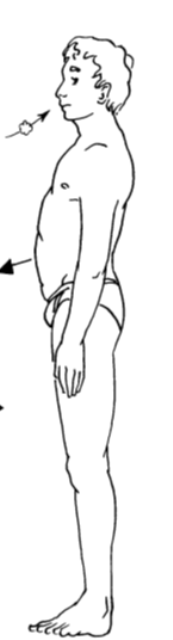
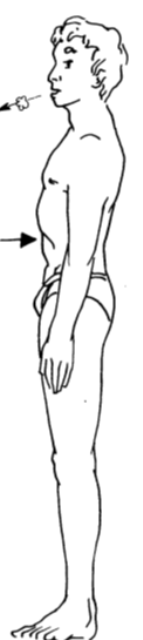
J ’inspire en gonflant le ventre Je souffle en rentrant le ventre
……Donc fait appel à des muscles
Les muscles intercostaux externes, tout comme les muscles intercostaux internes, s'insèrent sur deux côtes successives.
Leur action antagoniste s'explique essentiellement par la différence de longueur du levier sur la côte supérieure ou inférieure : la distance entre le point d'insertion des muscles intercostaux externes sur la côte supérieure (B) et l'axe de rotation de cette côte (A) est inférieure à la distance entre le point d'insertion de ces muscles sur la côte inférieure (C') et son axe de rotation (A').
Cette dernière longueur de levier C'-A' est donc supérieure à la longueur de levier A-B, de sorte que la contraction de ces muscles entraîne un soulèvement des côtes.
Les muscles intercostaux internes ont une action antagoniste, ce qui conduit à un abaissement de la cage thoracique lors de leur contraction.
Pour que les mouvements du diaphragme et de la cage thoracique puissent être utilisés pour la ventilation, il faut que les poumons puissent suivre ces mouvements, mais sans être fixés entièrement à la cage thoracique et au diaphragme.
Ceci est réalisé grâce à l'existence d'un film très mince de liquide se trouvant entre les deux feuillets de la plèvre qui recouvrent les poumons (plèvre pulmonaire) d'une part, et les organes avoisinants (plèvre pariétale) d'autre part.
Dans sa position naturelle, le poumon a tendance à s'affaisser sur lui-même du fait de sa propre élasticité.
Mais comme le liquide contenu dans la cavité pleurale est incompressible, le poumon reste solidaire de la face interne de la cage thoracique, ce qui conduit à une attraction, donc une pression négative par rapport à la pression environnante (pression intrapleurale, également appelée pression intrathoracique [Ppl] ; B).
Durant l'inspiration, lorsque la cage thoracique augmente de volume l'attraction augmente; par contre au moment de l'expiration elle devient plus faible (B).
Ce n'est qu'en cas d'expiration forcée faisant intervenir les muscles expiratoires (cf. ci-dessus) que Ppl, peut devenir positive.
La respiration c’est l ’alternance :
- d ’inspiration (entrée de l ’air)
- d ’expiration (sortie de l ’air)
L'INSPIRATION
DIAPHRAGME
C’est le muscle inspiratoire PRINCIPAL
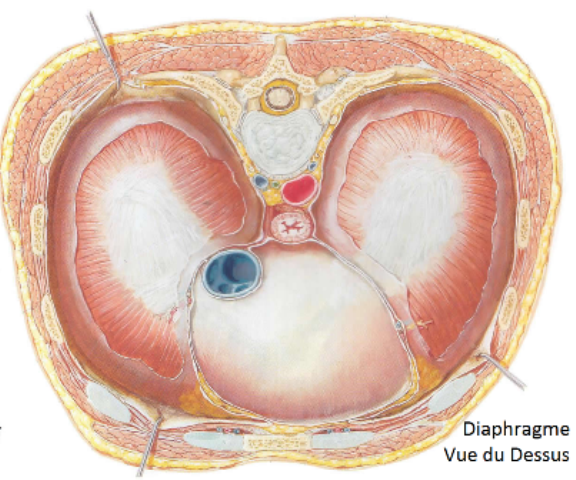
Le diaphragme, le muscle inspiratoire le plus important, est un muscle squelettique en forme de dôme qui forme le plancher de la cavité thoracique.
Il est innervé par les fibres des nerfs phréniques, qui émergent des deux côtés de la moelle épinière aux niveaux des troisième, quatrième et cinquième segments cervicaux.
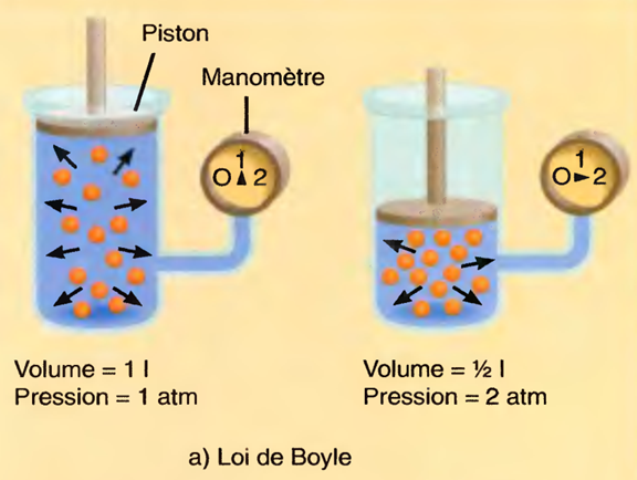
La loi de Boyle s'applique au fonctionnement d'une pompe de bicyclette et au gonflement d'un ballon.
Les différences de pression forcent l'air à entrer dans nos poumons lorsque nous inspirons, et l'expulsent hors des poumons lorsque nous expirons.
Pour que nous puissions inspirer, les poumons doivent augmenter de volume.
L'expansion des poumons entraîne une augmentation du volume pulmonaire et, par conséquent, une réduction de la pression dans les poumons, laquelle devient inférieure à la pression atmosphérique.
La première étape conduisant à l'expansion des poumons nécessite la contraction des principaux muscles inspiratoires : le diaphragme et les muscles intercostaux externes
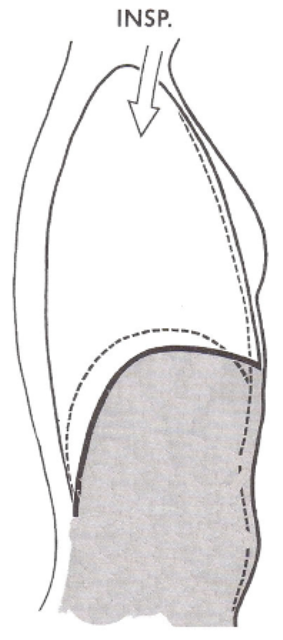
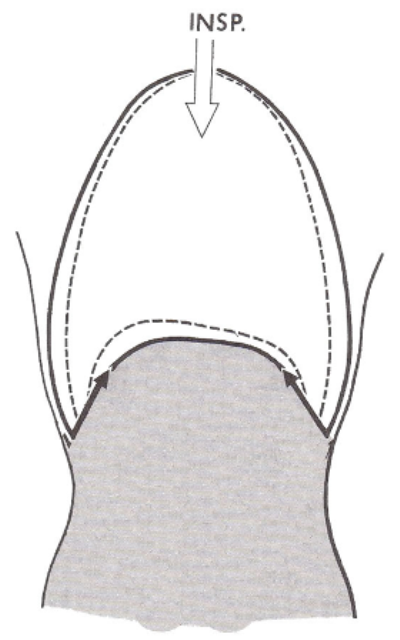
Lorsque le diaphragme se contracte, il s'aplatit, abaissant ainsi son dôme.
Ceci augmente le diamètre vertical de la cavité thoracique et est responsable du déplacement de 75 % de l'air qui pénètre dans les poumons durant l'inspiration. Durant la respiration calme et normale, le diaphragme se déplace de 1 cm, et jusqu'à près de 10 cm durant une respiration profonde.
La grossesse avancée, l'obésité ou le port de vêtements qui compriment l'abdomen peuvent empêcher la descente complète du diaphragme.
Pendant que le diaphragme se contracte, les muscles intercostaux externes se contractent également.
Ces muscles squelettiques sont disposés obliquement vers le bas et vers l'avant entre les côtes adjacentes.
Quand ils se contractent, ils entraînent le soulèvement des côtes, ce qui a pour effet de pousser le sternum vers l'avant et d'augmenter le diamètre antéro-postérieur de la cavité thoracique.
Durant la respiration normale, la pression intra-pleurale, c'est-à-dire la pression entre les deux plèvres, est toujours inférieure à la pression atmosphérique.
(Elle ne peut devenir temporairement positive que durant un mouvement respiratoire modifié, comme pendant la toux ou un effort de défécation.)
Juste avant l'inspiration, cette pression est inférieure d'environ 4 mm Hg à la pression atmosphérique,c'est-à-dire qu'elle s'élève à 756 mm Hg, si la pression atmosphérique est de 760 mm Hg .
La contraction du diaphragme et l'augmentation totale du volume de la cavité thoracique font baisser la pression intrapleurale à 754 mm Hg environ. Par conséquent, les parois des poumons sont tirées vers l'extérieur.
Normalement, les plèvres pariétale et viscérale sont fermement attachées l'une à l'autre à cause de la pression inférieure à la pression atmosphérique qu'il y a entre elles et de la tension superficielle créée par leurs surfaces adjacentes humides.
Lorsque la cavité thoracique se dilate, la plèvre pariétale qui tapisse la cavité est tirée vers l'extérieur dans toutes les directions, et la plèvre viscérale et les poumons suivent le mouvement.
Lorsque le volume des poumons augmente, la pression qui se trouve à l'intérieur des poumons, appelée pression intra-alvéolaire (intra-pulmonaire), passe de 760 mm Hg à 758 mm Hg.
Un gradient de pression est donc établi entre l'atmosphère et les alvéoles pulmonaires.
L'air passe de l'atmosphère dans les poumons en raison d'une différence de pression gazeuse, et l'inspiration a lieu.
L'air poursuit son mouvement dans les poumons, tant qu'il existe une différence de pression.
LES MUSCLES INSPIRATOIRES ACCESSOIRES
les muscles inspiratoires accessoires contribuent également à l'augmentation du volume de la cavité thoracique.
Ils comprennent les muscles sterno-cléido-mastoïdiens, qui soulèvent le sternum; les muscles scalènes, qui soulèvent les deux côtes supérieures ; et le muscle petit pectoral, qui soulève les troisième, quatrième et cinquième côtes.
L'inspiration est considérée comme un processus actif, parce qu'elle est déclenchée par une contraction musculaire.
L’ EXPIRATION
Processus passif
L'expiration passive est le mouvement de l'air qui sort des poumons ; elle fait également appel à un gradient de pression, mais, ici, le gradient est inversé : la pression intra-alvéolaire est supérieure à la pression atmosphérique.
Contrairement à l'inspiration, une expiration normale durant une respiration tranquille est un processus passif, puisqu'elle n'exige pas de contractions musculaires.
Elle dépend de deux facteurs :
- la rétraction des fibres élastiques qui ont été étirées durant l'inspiration,
- la traction vers l'intérieur de la tension superficielle due à la pellicule de liquide alvéolaire
L'expiration débute par le relâchement des muscles inspiratoires.
Lorsque les muscles intercostaux externes se relâchent, les côtes s'abaissent et, lorsque le diaphragme se relâche, son dôme s'élève en raison de son élasticité.
Ces mouvements entraînent une réduction des diamètres vertical et antéro-postérieur de la cavité thoracique.
De plus, la tension superficielle exerce une traction vers l'intérieur et les membranes basales élastiques des alvéoles et les fibres élastiques dans les bronchioles et les canaux alvéolaires se rétractent.
Par conséquent, le volume pulmonaire décroît et la pression intra-alvéolaire augmente, s'élevant à 762 mm Hg.
L'air circule alors de la région de haute pression dans les alvéoles vers la région de basse pression dans l'atmosphère
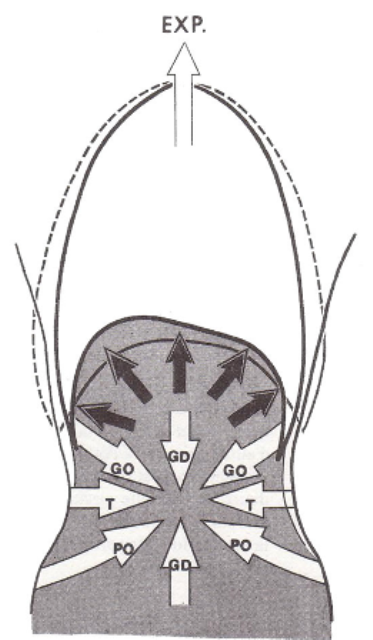
Processus actif
- L'expiration devient un processus actif durant la respiration laborieuse et lorsque le mouvement de l'air hors des poumons est empêché.
- Dans ces cas, les muscles de l'expiration -les muscles abdominaux et intercostaux internes- se contractent.
- La contraction des muscles abdominaux déplace les côtes inférieures vers le bas et comprime les viscères abdominaux, ce qui entraîne l'élévation du diaphragme.
- La contraction des muscles intercostaux internes, qui s'étendent vers le bas et vers l'arrière entre les côtes adjacentes, tire les côtes vers le bas.
Remarque:
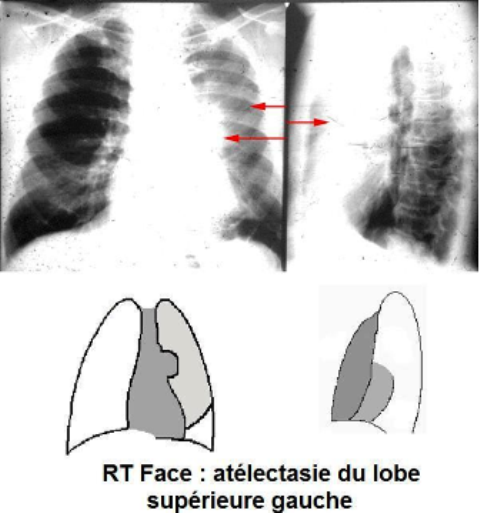
L’atélectasie (affaissement des poumons)
Il est vital de maintenir une pression intrapleurale peu élevée pour le fonctionnement des poumons.
En fin d’expiration, les alvéoles ont tendance à se rétracter et à s'affaisser sur eux-mêmes, comme les parois d'un ballon dégonflé.
L'atélectasie (ateles: incomplet; ektasis: dilatation) est l'affaissement d'un poumon ou d'une portion de poumon.
La présence de surfactant alvéolaire empêche l'affaissement des alvéoles.
Il tend à réduire la tension superficielle dans les poumons.
Donc, lorsque le volume des alvéoles décroît (après une expiration, par exemple), la tendance des alvéoles à s'affaisser est réduite par le fait que la tension superficielle n'augmente pas.
La compliance pulmonaire
La compliance pulmonaire correspond à la facilité avec laquelle les poumons et la paroi thoracique peuvent être étirés.
Une compliance élevée signifie que les poumons et la paroi thoracique se dilatent facilement, alors qu'une compliance peu élevée indique qu'ils résistent à la dilatation.
La compliance est liée à 2 facteurs principaux :
- l'élasticité et la tension superficielle.
- La présence de fibres élastiques dans le tissu pulmonaire et de surfactant dans le liquide alvéolaire permet une compliance élevée.
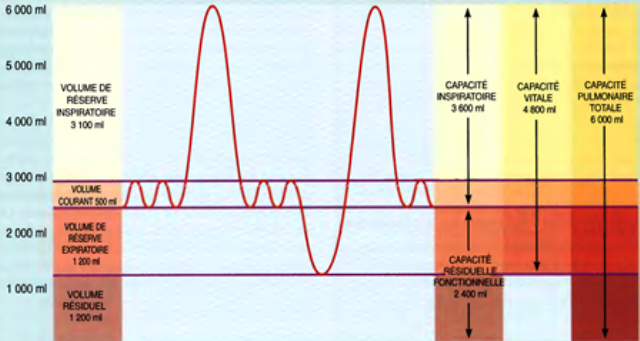
Les volumes et capacités pulmonaires
L'adulte en bonne santé respire environ 12 fois par minute, et 6 litres d'air environ entrent et sortent des poumons en période de repos.
Un volume d'échange d'air inférieur à la normale indique généralement un dysfonctionnement pulmonaire.
Le spirographe (spiro: respirer) est l'appareil habituellement utilisé pour mesurer le volume des échanges d'air durant la respiration, ainsi que le taux de la ventilation.
L'enregistrement obtenu est un spirogramme.
L'inspiration est enregistrée sous forme d'une déflexion vers le haut et l'expiration est enregistrée sous forme d'une déflexion vers le bas.
Les volumes pulmonaires
- Lors de la respiration normale, ≈ 500 ml d'air pénètrent dans les voies respiratoires à chaque inspiration (même volume lors de l’expiration)......
= volume courant (VT)
- Sur les 500 ml, ≈ 350 ml du volume courant atteignent les alvéoles. 150 ml se trouvent dans les cavités du nez, du pharynx, du larynx, de la trachée, des bronches, et des bronchioles................
= espace mort anatomique.
- le volume total d'air qui pénètre dans les poumons / minute......................
= La ventilation mn = Vc x Fr/mn
- 500 ml fois 12 respirations par mn, ou 6 000 ml/mn...............................
= Le volume moyen
- profonde inspiration, nous aspirons un volume d'air bien supérieur à 500 ml (3100 ml au-dessus des 500 ml du volume courant)..............
= volume de réserve inspiratoire (VRI).
- inspiration normale, puis expirons forcée, nous devrions pouvoir exhaler 1 200 ml d'air, en plus des 500 ml du volume courant................
=volume de réserve expiratoire (VRE).
- Même après l'expulsion du VRE, il reste un volume assez important d'air dans les poumons, (parce que la pression intrapleurale plus faible permet aux alvéoles de retenir un certain volume d'air); il reste également un certain volume d'air dans les voies respiratoires qui ne peuvent s'affaisser.........
= volume résiduel ≈1 200 ml (VR).
Les capacités pulmonaires
- Les capacités pulmonaires sont des combinaisons de différents volumes pulmonaires .
- VT + VRI = CI (capacité inspiratoire) = 3 600 ml
- VR + VRE = CRF (capacité résiduelle fonctionnelle )= 2 400ml.
- VRI+VT+VRE= CV (la capacité vitale) = 4800 ml
- (CT)la somme de tous les volumes = la capacité pulmonaire totale = 6 000 ml.
LES ECHANGES GAZEUX
LES LOIS PHYSIQUES
loi de Boyle
Suivant la loi de Boyle, le volume d'un gaz varie inversement à la pression,
Pour la petite histoire....
La loi de Boyle-Mariotte (souvent appelée loi de Boyle par les anglophones, loi de Mariotte ou loi de Boyle-Mariotte par les francophones) est une des lois de la thermodynamique du gaz réel.
Elle relie la pression et le volume d'un gaz réel à température constante.
On trace ainsi une courbe isotherme du gaz.
Mariotte et Boyle ont constaté, à quelques pour cent près, que la courbe p = f(V) était proche d'une hyperbole équilatère en coordonnées dites de Clapeyron (p,V), soit pV = constante pour une température donnée constante.
En d'autres termes, maintenir la température constante pendant une augmentation de pression d'un gaz exige une diminution de volume.
Inversement, la réduction de la pression du gaz passe par une augmentation de volume.
La valeur exacte de la constante n'a pas besoin d'être connue pour appliquer la loi entre deux volumes de gaz sous des pressions différentes, à la même température :
La loi a été découverte à quelques années d'intervalle par l'Irlandais Robert Boyle (en 1662) et par le Français Edme Mariotte (en 1676).
C'est Guillaume Amontons qui précisa en 1702 que cette loi n'est valable qu'à température constante et est plus précise aux basses pressions.
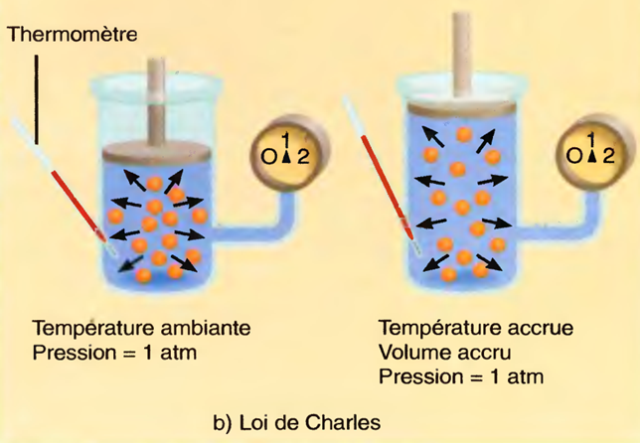
Loi de Charles
Selon la loi de Charles, le volume d'un gaz est directement proportionnel à la température, en supposant que la pression reste constante.
Lorsque le gaz est chauffé, les molécules gazeuses se déplacent plus vite et le nombre de collisions dans le cylindre augmente.
la force des molécules qui frappent le piston le font se déplacer vers le haut.
Alors que le gaz se dilate, le mouvement du piston donne une mesure de l'augmentation de volume.
À mesure que l'espace dans le cylindre augmente, les molécules doivent se déplacer plus loin, si bien que le nombre de collisions diminue à mesure que l'espace augmente.
La pression initiale est maintenue, et le volume augmente proportionnellement à l'augmentation de la température.
Lorsque les gaz entrent dans les poumons réchauffés, ils se dilatent, entraînant l'augmentation du volume pulmonaire.
La loi de Dalton
Selon la loi de Dalton, chaque gaz présent dans un mélange de gaz exerce sa propre pression, indépendamment des autres gaz.
On appelle pression partielle la pression d'un gaz spécifique dans un mélange ; elle correspond à p.
la somme des pressions partielles = pression totale
L'air atmosphérique est un mélange de plusieurs gaz (oxygène, gaz carbonique, azote, vapeur d'eau, ainsi qu'un certain nombre d'autres gaz présents en quantités minimes et négligeables).
Nous pouvons déterminer la p exercée par chaque gaz du mélange en multipliant le pourcentage du gaz dans le mélange par la pression totale du mélange.
Par exemple, pour connaître la p de l‘O2 dans l'atmosphère, on multiplie le pourcentage d'air atmosphérique composé d'oxygène (21 %) par la pression atmosphérique totale (760 mm Hg) : p02 atmosphérique = 21 % x 760 mm Hg
- = 159,60 ou 160 mm Hg
Comme le pourcentage de CO2 dans l'atmosphère est égal à 0,04, pC02 atmosphérique = 0,04 % x 760 mm Hg
- = 0,3 mm Hg
La loi de Henry
La capacité d'un gaz de se maintenir en solution dépend de sa pression partielle et de son coefficient de solubilité, c'est-à-dire de son attraction physique ou chimique pour l'eau.
Ou autrement dit... A température constante et à saturation, la quantité de gaz dissout dans un liquide est proportionnelle à la pression qu'exerce ce gaz sur le liquide.
La loi de HENRY régit donc le comportement des gaz mis en contact avec des liquides. Enoncé de la loi: les gaz sont solubles dans les liquides. La quantité de gaz dissous sera fonction :
- de la pression partielle du gaz
- du coefficient de solubilité du gaz (constant pour un gaz donné dans un liquide donné)
- de l'inverse de la température.
- de la durée du contact gaz / liquide.
Les gaz vont se dissoudre progressivement selon une courbe exponentielle jusqu'à « saturation ».
Le coefficient de solubilité du gaz carbonique est élevé (0,57), celui de l'oxygène l'est moins (0,024), et celui de l'azote encore moins (0,012).
Plus la pression partielle exercée par un gaz sur un liquide est élevée et plus le coefficient de solubilité est élevé, plus le gaz aura tendance à rester en solution.
la loi de Henry : la quantité de gaz qui se dissout dans un liquide est proportionnelle à la pression partielle exercée par ce gaz et à son coefficient de solubilité, sous une température constante.
La loi de Henry explique deux conditions dues aux changements de la solubilité de l'azote dans les liquides corporels.
Même si l'air que nous respirons contient environ 79 % d'azote, ce gaz n'a aucun effet connu sur les fonctions corporelles, puisque, à cause du coefficient peu élevé de solubilité de ce gaz à la pression du niveau de la mer, seule une très petite quantité d'azote se dissout dans le plasma sanguin.
LES ECHANGES GAZEUX
Les échanges gazeux s’effectuent à 2 niveaux :
- Pulmonaire (O2 entre poumons sang / CO2 sort sang poumons)
- Les échanges gazeux se font par diffusion :
Le passage des gaz a travers les membranes perméables au gaz suit le gradient de pression : on dit que les gaz diffusent du milieu ou la pression est la plus élevée vers le milieu ou la pression est plus faible.
1. La physiologie de la respiration pulmonaire
La respiration externe (pulmonaire) est l'échange d'oxygène et de gaz carbonique entre les alvéoles et les capillaires pulmonaires.
Elle entraîne la conversion du sang désoxygéné (pauvre en O2) en provenance du cœur en sang oxygéné (saturé en O2) retournant au cœur.
La p02 de l'air alvéolaire est de 105 mm Hg.
La p02 du sang désoxygéné qui pénètre dans les capillaires pulmonaires n'est que de 40 mm Hg en période de repos.
A cause de cette différence dans les p02, l'oxygène diffuse des alvéoles vers le sang désoxygéné, jusqu'à ce qu'un équilibre soit atteint, et la p02 du sang maintenant oxygéné est de 105 mm.
En arrivant dans les poumons, la pC02 du sang pulmonaire désoxygéné est de 45 mm Hg, alors que celle des alvéoles est de 40 mm Hg.
À cause de cette différence dans la pC02, le gaz carbonique diffuse du sang désoxygéné vers les alvéoles jusqu'à ce que la pC02 du sang soit réduite à 40 mm Hg.
Le taux de la respiration externe dépend de plusieurs facteurs.
- Différence de pression partielle.
- Surface d'échange gazeux disponible.
- Distance de diffusion.
- La fréquence et l'amplitude respiratoires.
Différence de pression partielle.
- Aussi longtemps que la p02 des alvéoles est supérieure à celle du sang veineux, l'oxygène diffuse des alvéoles au sang (altitude).
Surface d'échange gazeux disponible.
La surface totale disponible pour les échanges Oxygène gaz carbonique est importante ≈ 70 m² (emphysème)
Distance de diffusion.
L'épaisseur totale des membranes alvéolo-capillaires n'est que de 0,5 µm.
Les capillaires sont tellement étroits que les globules rouges doivent y circuler l'un derrière l'autre.
L'accumulation de liquide, comme dans le cas de l'œdème pulmonaire, réduit le taux des échanges gazeux, parce qu'elle entraîne l'augmentation de la distance de diffusion.
La fréquence et l'amplitude respiratoires.
(la morphine ralentit la fréquence respiratoire)
La physiologie de la respiration tissulaire
La respiration interne (tissulaire) est l'échange d'oxygène et de gaz carbonique entre les capillaires sanguins des tissus et les cellules des tissus.
Elle entraîne la conversion du sang oxygéné en sang désoxygéné.
L'O2
La p02 du sang oxygéné qui entre dans les capillaires tissulaires est de 105 mm Hg, alors que celle des cellules des tissus est de 40 mm Hg.
A cause de cette différence, l‘O2 diffuse dans le liquide interstitiel et les cellules des tissus, jusqu'à ce que la p02 du sang soit réduite à 40 mm Hg, ce qui correspond à la p02 du sang désoxygéné des capillaires tissulaires en période de repos.
Au repos, environ 25 % de l'O2 disponible dans le sang oxygéné pénètre dans les cellules des tissus.
Ce volume est suffisant pour répondre à leurs besoins en situation de repos.
LE CO2
La pCo2 moyenne des cellules des tissus est de 45 mm Hg, alors que celle du sang oxygéné des capillaires est de 40 mm Hg.
Par conséquent, le gaz carbonique des cellules diffuse dans le liquide interstitiel et le sang oxygéné, jusqu'à ce que la pCo2 du sang soit de 45 mm Hg, ce qui correspond à la pCo2 du sang désoxygéné des capillaires tissulaires.
Le sang désoxygéné retourne ensuite au cœur.
De là, il est propulsé vers les poumons, et un autre cycle de respiration externe commence.
LE TRANSPORT D'O2 ET DE CO2
L'O2
L'O2 ne se dissout pas facilement dans l'eau ;
- 1,5 % à l’état dissous dans le cytoplasme des hématies et dans le plasma.
- 98,5% combiné à l’Hb sous forme d’oxyHb.
L’O2 se fixe réversiblement sur les atomes de fer de l’héme :
Hb + 4O2 ↔ Hb(O2)
Hb + O2 ↔ HbO2
Hémoglobine désoxygénée Oxygène Oxyhémoglobine
(hémoglobine réduite)
Étant donné que 98,5 % de l'O2 se fixe à l'hémoglobine et est emprisonné à l'intérieur des globules rouges, seul l'O2 dissous (1,5 %) peut diffuser des capillaires des tissus aux cellules des tissus.
A mesure que l'oxygène passe des alvéoles aux globules rouges, l'hémoglobine se sature d'oxygène et devient donc un acide plus fort.L'hémoglobine plus acide libère un plus grand nombre d'ions hydrogène (H+) qui se combinent à l'HCO3- pour former de l'acide carbonique (H2CO3).Celui-ci se dissocie en H2O + CO2, et le CO2 diffuse du sang aux alvéoles (effet Haldane).
À mesure que le gaz carbonique quitte les cellules tissulaires et entre dans les globules rouges, il incite une plus grande quantité d'oxygène à se séparer de l'hémoglobine (effet Bohr) et, par conséquent, une plus grande quantité de gaz carbonique se combine à l'hémoglobine et plus d'ions bicarbonate (HCO3-) sont produits.
LE CO2
Dans des conditions normales de repos, chaque volume de 100 ml de sang désoxygéné contient 5 ml de gaz carbonique.
Le CO2 est transporté par le sang sous 3 formes principales .
- Le CO2 dissous.
- La carbhémoglobine.
- Les ions bicarbonate.
1. Le CO2 dissous.
Le plus petit pourcentage, environ 7 %, est dissous dans le plasma. En atteignant les poumons, il diffuse dans les alvéoles pulmonaires.
2. La carbhémoglobine.
Une partie plus importante, équivalant à environ 23 %, se combine à la globine contenue dans l'hémoglobine pour former
la carbhémoglobine sous l’influence de la pCO2 .
Ainsi, dans les capillaires tissulaires, la pCO2 est relativement élevée, ce qui favorise la formation de la carbHb.
Toutefois, dans les capillaires pulmonaires, la pCO2 est relativement basse, et le CO2 se sépare facilement de la globine et pénètre dans les alvéoles par diffusion.
3. Les ions bicarbonate.
70 % du CO2 est transporté dans le plasma sous forme d'ions bicarbonate.
À mesure que le CO2 diffuse dans les capillaires tissulaires et pénètre dans les globules rouges, il réagit avec l'eau, en présence de l'enzyme anhydrase carbonique, pour former de l'acide carbonique .
Celui-ci se dissocie en ions H+ et en ions HCO3-.
Les ions H+ se combinent principalement à l'hémoglobine ou à d'autres tampons.
A mesure que les ions HCO3- s'accumulent dans les globules rouges, certains d'entre eux diffusent et pénètrent dans le plasma, suivant leur gradient de concentration.
En échange, les ions chlorure (Cl-) diffusent du plasma vers les globules rouges.
Cet échange d'ions négatifs maintient l'équilibre ionique entre le plasma et les globules rouges ; c'est ce que l'on appelle le phénomène de Hamburger.
L'effet net de ces réactions est que le CO2 des cellules est transporté dans le plasma sous forme d'ions bicarbonate.
FACTEURS INFLUENÇANT LES ECHANGES GAZEUX
- La pO2 (courbe de Barcroft)
- La pCO2
- La température (T°C)
- Le pH
- Le BPG.
1. pO2 : Caractéristiques de la courbe de % de saturation de l’Hb en O2 :
La courbe a une allure sigmoïde ce qui montre que la fixation de l’O2 sur l’Hb dépend de la pO2
Le % de saturation de l’Hb augmente avec l’augmentation de la pO2 mais pas de manière proportionnelle (ce n’est pas une droite)
Les autres facteurs chimiques qui influencent la formation et la dissociation de l’oxyhb
2. La pCO2
3. La température (T°C)
4. Le pH
5. Le BPG.
Le BPG. Une substance présente dans les GR, appelées 2,3-biphosphoglycérate (BPG), appelé auparavant diphosphoglycérate, réduit l’affinité de l’Hb pour l’O2 et aide donc à libérer l’O2 de l’Hb.
Il s’agit d’un composé intermédiaire formé dans les Gr lorsqu’ils dégradent le glucose en énergie durant la glycoloyse.
Le BPG. Une substance présente dans les GR, appelées 2,3-biphosphoglycérate (BPG), appelé auparavant diphosphoglycérate, réduit l’affinité de l’Hb pour l’O2 et aide donc à libérer l’O2 de l’Hb.
Il s’agit d’un composé intermédiaire formé dans les Gr lorsqu’ils dégradent le glucose en énergie durant la glycoloyse.
Pour une pO2 élevée de 14kPa :
C’est le cas au niveau des poumons
- Le % d’oxyHb est voisin de 100% : l’Hb est donc saturée.
- On peut donc dire que l’affinité de l’Hb pour l’ O2 ne dépend pas des facteurs pCO2 , pH et T°.
Pour une pO2 faible de 4kPa :
C’est le cas au niveau des tissus
- Le % de saturation de l’Hb dépend des 3 facteurs étudiés.
Exemple:
Cas n°1 :
- La pCO2 augmente = hypercapnie (activité cellulaire importante)
- Le pH diminue (plus acide a cause de la libération d’ions H+ par les muscles en activite)
- La T° augmente (tissus actifs ou fièvre)
→ Les courbes de saturation de l’Hb en oxygène sont décalées vers la droite.
Signification : Pour une même pO2, le % de saturation de l’Hb en oxygène diminue,
Donc l’affinité de l’Hb pour l’O2 diminue
Donc la dissociation de l’oxyHb augmente et la libération d’O2 augmente.
Conclusion : L’O2 est fourni aux tissus (HbO2 Hb + O2)
L’ensemble des facteurs qui facilitent la libération de l’ O2 par l’Hb constitue l’effet Bohr.
Cas n°2 :
- La pCO2 diminue = hypocapnie (activité cellulaire faible)
- Le pH augmente (plus basique)
- La T° diminue
→ Les courbes de saturation de l’Hb en oxygène sont décalées vers la gauche.
Signification : Pour une même pO2, le % de saturation de l’Hb en oxygène augmente,
Donc l’affinité de l’Hb pour l’O2 augmente
Donc la dissociation de l’oxyHb diminue et la libération d’O2 diminue.
Conclusion : Les tissus moins actifs ont moins besoin d’O2.
LA REGULATION DE LA RESPIRATION
Au repos consommation → 200 ml d’O2 /mn
Effort → x 30 .
→ Existence des mécanismes pour adapter l'effort respiratoire aux besoins métaboliques.
→ Le rythme de base de la respiration est réglé par certaines parties du système nerveux situées dans le bulbe rachidien et la protubérance.
La régulation nerveuse
Changement des dimensions du thorax par l'action des muscles respiratoires.
Ces muscles se contractent et se relâchent sous l'effet d'influx nerveux qui leur sont transmis par des centres nerveux de l'encéphale.
La région d'où partent ces influx nerveux est située en position bilatérale dans la formation réticulée du tronc cérébral ; on l'appelle le centre respiratoire.
Ce centre est formé d'un groupe de neurones dispersés, divisé, sur le plan fonctionnel, en trois régions :
- le centre de rythmicité bulbaire ;
- le centre pneumota- xique, situé dans la protubérance;
- le centre apneu- stique, également situé dans la protubérance.
Le centre de rythmicité bulbaire
Le rôle du centre de rythmicité bulbaire est de régler le rythme de base de la respiration.
le centre pneumotaxique
Aide à coordonner la transition entre l'inspiration et l'expiration.
L’influx nerveux favorise l'inhibition de l'activité du centre inspiratoire avant que les poumons ne contiennent un volume d'air excessif.
Autrement dit, les influx limitent l'inspiration et facilitent ainsi l'expiration.
Lorsque le centre pneumotaxique est plus actif, le rythme de la respiration est plus rapide.
Le centre apneustique
coordonne la transition entre l'inspiration et l'expiration.
Ce centre envoie des influx stimulateurs au centre inspiratoire pour activer et prolonger l'inspiration, inhibant ainsi l'expiration.
Cette situation survient lorsque le centre pneumotaxique est inactif.
Lorsque le centre pneumotaxique est actif, il domine le centre apneustique.
La régulation de l’activité du centre respiratoire
Bien que le rythme de base de la respiration soit établi et coordonné par le centre respiratoire, ce rythme peut être modifié selon les besoins métaboliques de l'organisme par des influx nerveux dirigés vers ce centre.
Les influences corticales
Le cortex cérébral étant relié au centre respiratoire, nous pouvons donc modifier volontairement notre respiration (mesure de protection)
Le réflexe de Hering-Breuer
Par l’étirement des mécanorécepteurs due au gonflement de la cage thoracique
La régulation chimique
Rôle des chémorécepteurs (centraux et périphériques)
Les propriocepteurs
Récepteurs qui surveillent les mouvements articulaires et les contractions musculaires.
|
Variables régulées |
capteurs |
effecteurs |
|---|---|---|
|
PCO2 pH |
chémorécepteurs centraux |
ventilation |
|
PO2 [O2] PCO2 |
chémorécepteurs périphériques |
ventilation débit sanguin résistances vasculaires |
|
PO2 |
capteurs rénaux |
érythropoïèse |
Les autres influences
- La température: Une élévation augmente la fréquence
- respiratoire, un refroidissement soudain la réduit.
- La douleur soudaine et intense entraîne une apnée, mais une douleur prolongée augmente la respiration.
- L'étirement des sphincters de l'anus augmente la fréquence
- L'irritation des voies respiratoires (mécanique ou chimique du pharynx ou du larynx), entraîne une interruption immédiate de la respiration, suivie d'une toux ou d'un éternuement.
Insuffisance respiratoire aiguë-JF Muir, A Cuvelier-Encyclopédie Pratique de Médecine -Arrangement BMS
Définition
L’insuffisance respiratoire aiguë peut être définie comme l’impossibilité pour le système ventilatoire de maintenir des échanges gazeux à un niveau compatible avec la survie autonome de l’organisme. Son marqueur biologique princeps est l’hypoxémie, associée ou non à une hypercapnie
L’insuffisance respiratoire est généralement définie par l’existence d’une hypoxémie chronique d’origine respiratoire intrinsèque, c’est-à-dire associée le plus souvent à des perturbations de la fonction respiratoire.
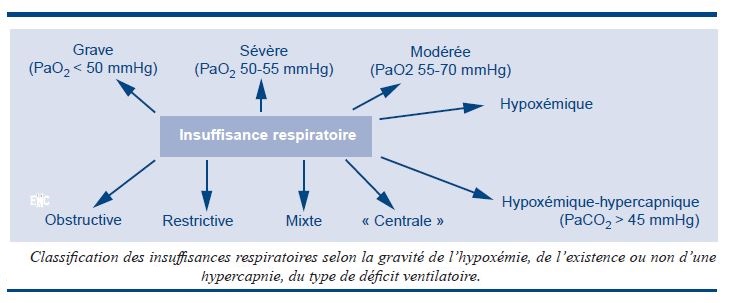
L’hypoxémie, quant à elle, est définie par une PaO2 < 70 mmHg. L’hypercapnie, (PaCO2 > 45 mmHg), n’est pas obligatoire, mais elle est souvent présente dans les IRC obstructives.
Le caractère chronique c’est-à-dire persistant de l’hypoxémie, est un élément important ; il doit être vérifié par des mesures de gaz du sang artériel, pratiquées à un mois d’intervalle, à distance d’un épisode aigu.
Différence entre l’insuffisance respiratoire chronique et l’insuffisance respiratoire aiguë
L’insuffisance respiratoire aiguë se définit comme l’impossibilité pour un malade de maintenir une hématose normale. Le trouble de l’hématose est caractérisé par une altération des gaz du sang (GDS) avec :
- une hypoxémie : la pression partielle du sang artériel en oxygène (PaO2) est inférieure à 80 mmHg et la saturation de l’hémoglobine en oxygène (SaO2) est inférieure à 95 % ;
- associée ou non à une hypercapnie : la pression partielle du sang artériel en gaz carbonique (PaCO2) est supérieure alors à 45 mmHg. Selon l’étiologie, l’hypercapnie peut être absente ou remplacée par une hypocapnie.
-
Dans l’insuffisance respiratoire chronique (IRC), les mécanismes de compensation mettant en jeu la réserve cardiorespiratoire permettent l’adaptation de l'organisme aux troubles de l’hématose :
↗ de la ventilation minute (Vmin),
↗ du travail ventilatoire (Work Of Breathing, ou WOB),
↗ du débit cardiaque (Qc).
Ils sont suffisants pour assurer durablement une stabilité des GDS.
Dans l’insuffisance respiratoire aiguë (IRA), la réserve cardiorespiratoire est insuffisante.
Des signes cliniques de détresse respiratoire aiguë apparaissent ainsi que des signes de défaillance cardiaque (cœur pulmonaire aigu) et des troubles neuropsychiques.
Les gaz du sang s’altèrent, la PaO2 est inférieure à 60 mmHg et la saturation de l’hémoglobine inférieure à 90 %, l’hypercapnie, si elle existe, est instable et supérieure à 60
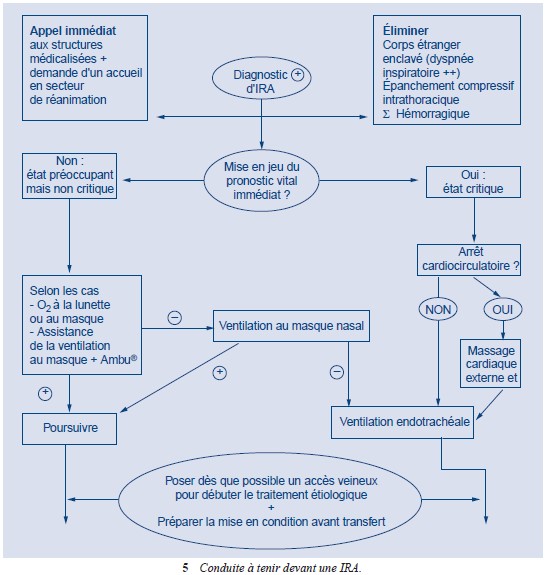
Diagnostic de L’IRA
En dehors de l’hôpital : analyse de la symptomatologie clinique définissant le syndrome d’IRA, et surtout appréciation de la tolérance de celle-ci, qui sert de guide à l’instauration parfois immédiate d’une thérapeutique, souvent symptomatique à ce stade.
En milieu hospitalier, le diagnostic + => examens paracliniques (GDS)
Le diagnostic est en règle générale aisé, quelle que soit la cause de l’IRA, devant la présence d’un trisyndrome évocateur
1. Signes respiratoires
Dyspnée à type de polypnée superficielle.
Parfois, on constate une bradypnée expiratoire évocatrice d’un bronchospasme.
La bradypnée inspiratoire => examen immédiat (si possible au laryngoscope puis endoscopie) à la recherche d’un obstacle au niveau des vas .
L’irrégularité ou le ralentissement progressif de la FR peuvent être les prémices à l’apnée => RCP
NB: inspection est capitale (cyanose, déformation constitutionnelle ou acquise de la cage thoracique, l’impact d’un traumatisme thoracique, etc…)
2. Signes circulatoires
Peuvent être à l’origine de l’IRA ou son retentissement :
Troubles du rythme divers, allant de la simple tachycardie réactionnelle aux accès de tachyarythmie ou, plus péjoratifs, de bradyarythmie (précurseur d’un arrêt)
3.Signes neurologiques
Anomalies variables en fonction de l’étiologie de l’IRA :
Cas de décompensation d’une IRC, existent des signes d’encéphalopathie respiratoire, parfois au premier plan, pouvant évoluer de la simple modification de l’humeur au syndrome confusionnel avec astérixis, myoclonies, bouffées d’agitation, voire au coma ;
Dans les autres formes étiologiques, les perturbations neurologiques sont aléatoires, réalisant un état d’agitation ou une obnubilation.
Diagnostic différentiel
La polypnée peut faire discuter une dyspnée sine materia d’origine neurogène ou métabolique ;
La cyanose peut prêter à discussion en cas de pigmentation cutanée, de doute quant au critère central de la coloration des téguments (cyanose périphérique par vasoconstriction), de méthémoglobinémie ou de sulfhémoglobinémie d’origine médicamenteuse ou toxique, de shunt droit-gauche.
Diagnostic étiologique
Diagnostic étiologique habituellement aisé
Contexte chirurgical :
- polytraumatisme,
- plaie thoracique,
- inhalation de corps étranger,
- IRA postopératoire,
- anémie aiguë isolée ou associée,
- noyade ;
Contexte médical :
- choc ou état de choc,
- pneumopathie grave (non immunodéprimé ; immunodéprimé/sida),
- décompensation d’une IRC connue ou d’étiologie évidente (déformé thoracique, maladie neuromusculaire, obésité morbide),
- état de mal asthmatique (EMA),
- embolie pulmonaire,
- œdème pulmonaire hémodynamique ou lésionnel,
- épanchement intrathoracique compressif,
- coma toxique ou d’autre origine.
-
Cas plus complexes
Il convient de rechercher la possibilité
- d’une embolie pulmonaire,
- d’une pneumopathie de déglutition,
- d’un œdème pulmonaire en voie de constitution,
- d’une cause toxique et/ou d’une origine purement cardiaque (trouble du rythme isolé ou sous la dépendance d’une insuffisance coronarienne latente, nécrose myocardique avec pseudoasthme cardiaque).
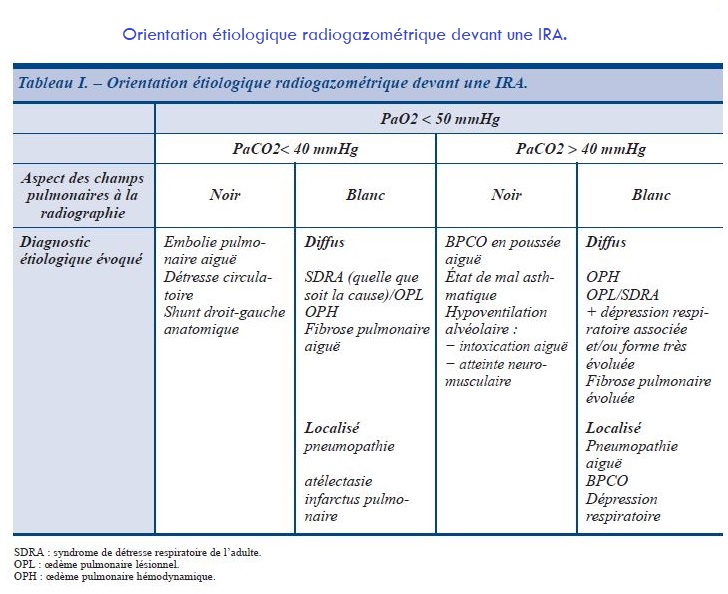
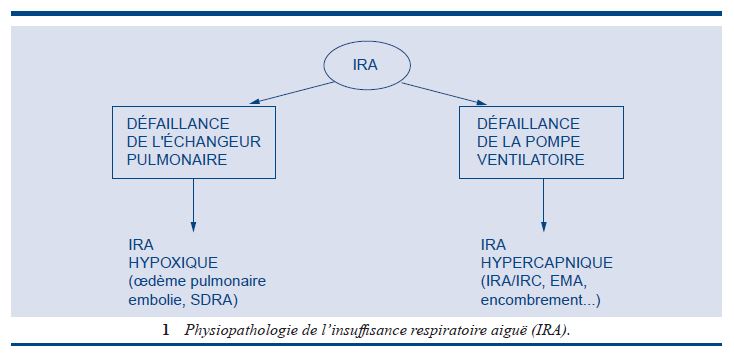
Physiopathologie de l’insuffisance respiratoire aiguë (IRA)
1. IRA dites hypoxémiques
Elles relèvent préférentiellement d’une atteinte de l’échangeur pulmonaire, avec élévation du gradient alvéoloartériel en O2 consécutif à l’effet shunt lié à l’atteinte parenchymateuse pulmonaire.
Il existe une hypoxémie sévère, associée à une acidose à prédominance métabolique liée à la chute du transport périphérique de l’oxygène. La PaCO2 est basse, puis s’élève en phase terminale.
On observe ce tableau paraclinique dans
- les pneumopathies graves,
- les œdèmes pulmonaires hémodynamiques et lésionnels (réalisant le tableau de syndrome de détresse respiratoire de l’adulte ou SDRA),
- les pneumopathies interstitielles chroniques (fibroses) en poussée asphyxique et l’embolie pulmonaire.
2.IRA dites hypercapniques
Elles comportent une hypoxémie associée à une hypercapnie avec acidose ventilatoire décompensée.
Le mécanisme principalement en cause ici est l’hypoventilation alvéolaire secondaire à une atteinte du soufflet thoracique dont l’origine peut intéresser n’importe quel niveau de la chaîne respiratoire s’étendant entre les centres de commande et l’effecteur musculaire (IRC restrictive pure secondaire à une atteinte du soufflet thoracique avec ou sans obésité associée, atteintes neuromusculaires, SLA, coma toxique).
Cette atteinte est responsable d’un état de fatigue aiguë des muscles respiratoires et notamment du diaphragme, qui deviennent incapables de générer les niveaux de pression nécessaires au renouvellement de l’air intra-alvéolaire.
3.IRA de type mixte
Elles regroupent les atteintes simultanées de l’échangeur et du soufflet thoracique, comme les IRC obstructives, les séquelles mutilantes de tuberculose, les traumatismes thoraciques qui peuvent présenter aussi un profil gazométrique hypoxique et hypercapnique.
Outre son intérêt dans la démarche étiologique, l’approche physiopathologique de l’IRA permet de moduler la prise en charge thérapeutique, dont les deux objectifs principaux sont :
- le contrôle de l’hypoxémie, qui conditionne le pronostic vital à la phase aiguë ;
- l’assistance puis la mise au repos des muscles respiratoires, dont la récupération est indispensable à la reprise d’une autonomie ventilatoire.
Stratégie thérapeutiques
- Insuffisance respiratoire chronique, E Weitzenblum, A Chaouat,MFaller, P Schinkewitch-Encyclopédie Pratique de Médecine -Arrangement BMS
Définition
L’insuffisance respiratoire est généralement définie par l’existence d’une hypoxémie chronique d’origine respiratoire intrinsèque, c’est-à-dire associée le plus souvent à des perturbations de la fonction respiratoire.
L’hypoxémie, quant à elle, est définie par une PaO2 < 70 mmHg. L’hypercapnie, (PaCO2 > 45 mmHg), n’est pas obligatoire, mais elle est souvent présente dans les IRC obstructives.
Le caractère chronique c’est-à-dire persistant de l’hypoxémie, est un élément important ; il doit être vérifié par des mesures de gaz du sang artériel, pratiquées à un mois d’intervalle, à distance d’un épisode aigu.
L’IRC sévère
L’IRC sévère est définie par une PaO2 < 55mmHg (nous verrons que c’est le critère généralement retenu pour l’oxygénothérapie à domicile) souvent, mais non obligatoirement associée à une PaCO2 > 50 mmHg.
Les IRC obstructives
Caractérisées par une chute du VEMS, des débits expiratoires maximaux et du rapport VEMS/capacité vitale (souvent < 50 %, voire < 35% dans l’irc sévère).
Les BPCO représentent, à elles seules, 90% des causes d’irc.
L’hypoxémie-hypercapnie est généralement précédée par une hypoxémie isolée.
- bronchite chronique obstructive associée ou non à l’emphysème
- emphysème
- asthme chronique avec obstruction bronchique permanente
- bronchiolite oblitérante
- bronchectasies diffuses
- mucoviscidose
- etc...
Les IRC restrictives
Caractérisées par une chute de la capacité pulmonaire totale (et de la capacité vitale), avec conservation d’un rapport VEMS/capacité vitale normal.
Les causes relativement fréquentes d’IRC sont les fibroses interstitielles diffuses, le plus souvent primitives, et les affections apparentées ; les scolioses et cyphoscolioses.
Dans les fibroses, l’hypoxémie est accompagnée d’hypocapnie ou de normocapnie ; dans les scolioses il existe, au contraire, une hypoxémie-hypercapnie.
d’origine neuromusculaire : séquelles de polio, myopathies, paralysie diaphragmatique bilatérale, etc
d’origine ostéoarticulaire : scolioses et cyphoscolioses sévères*, cyphoses, séquelles d’interventions chirurgicales mutilantes
d’origine pulmonaire :
- suite de pneumonectomie
- séquelles graves de tuberculose pulmonaire
- fibrose pulmonaire sarcoïdosique
- pneumoconioses
- fibroses pulmonaires interstitielles diffuses primitives*
- autres pneumopathies interstitielles (collagénoses, alvéolites allergiques extrinsèques, etc)
Les IRC mixtes
- bronchectasies diffuses
- pneumoconioses : silicose surtout
- séquelles importantes de tuberculose pulmonaire
- sarcoïdoses au stade III
Les IRC d’origine centrale
Sous la rubrique insuffisance respiratoire d’origine « centrale », on regroupe l’hypoventilation alvéolaire « centrale » vraie, qui est très rare chez l’adulte, et qui est liée à une perturbation du fonctionnement des centres respiratoires, alors que l’effecteur thoracopulmonaire est intact.
- hypoventilation alvéolaire centrale du nourrisson et de l’adulte
- syndrome obésité-hypoventilation (anciennement syndrome de Pickwick)
- syndrome d’apnées du sommeil* (n’occasionne que 10% d’ une insuffisance respiratoire hypercapnique )
Diagnostic clinique et paraclinique
Dans tous les cas
- radio thoracique
- électrocardiogramme
- gaz du sang artériel
- EFR et courbe débit-volume (par spirographie conventionnelle ou par pléthysmographie)
- test de marche (avec mesure oxymétrique de la saturation en oxygène)
Dans certains cas
1. examens morphologiques :
- tomodensitométrie thoracique : pneumopathies interstitielles, pneumoconioses, emphysèmes
- bronchofibroscopie : suspicion d’un cancer bronchique associé
2. fonction respiratoire et hémodynamique pulmonaire
en fonction de la gravité et des caractéristiques
- test de réversibilité de l’obstruction bronchique
- transfert du CO
- mesure de la compliance pulmonaire
- gaz du sang au repos + effort
- mesure de la VO2 max
- cathétérisme cardiaque droit}
Évolution
Principales complications évolutives
Les deux complications majeures de l’IRC sont les exacerbations aiguës, conduisant au tableau d’insuffisance respiratoire aiguë sur fond d’insuffisance respiratoire chronique, et l’évolution vers l’hypertension artérielle pulmonaire (HTAP) et le retentissement cardiaque droit.
Les poussées d’insuffisance respiratoire aiguë sont surtout caractéristiques des BPCO.
Elles associent une hypoxémie sévère (PaO2 < 50 mmHg) et une hypercapnie (PaCO2 > 50 mmHg).
Hypertension artérielle pulmonaire
Toute insuffisance respiratoire est susceptible d’évoluer vers l’hypertension artérielle pulmonaire (HTAP) et le retentissement cardiaque droit.
En effet, l’hypoxie alvéolaire cause la vasoconstriction pulmonaire et, lorsqu’elle est persistante, chronique (ce qui est le cas dans l’IRC), entraîne à la longue un « remodelage » du lit vasculaire pulmonaire :
modifications structurelles des petites artères précapillaires qui se traduisent par une augmentation des résistances vasculaires pulmonaires, laquelle conduit à l’hypertension pulmonaire.
Le rôle de l’hypoxie alvéolaire, dans la genèse de l’HTAP, est prédominant dans les BPCO, dans les IRC de type « central », mais aussi dans certaines IRC restrictives (cyphoscolioses par exemple).
Dans les fibroses pulmonaires, en revanche, c’est l’amputation anatomique du lit vasculaire pulmonaire qui est la cause majeure de l’HTAP.
Dans l’IRC, et en particulier dans l’IRC obstructive, l’HTAP est le plus souvent modérée, avec une pression artérielle pulmonaire moyenne (PAP), généralement comprise entre 20 et 35 mmHg, alors que dans l’HTAP primitive, dans l’HTAP thromboembolique et dans certaines cardiopathies congénitales, la PAP dépasse volontiers 50 mmHg.
L’HTAP des IRC est par ailleurs, une HTAP précapillaire, c’est-à-dire associée à une pression capillaire pulmonaire normale, à la différence de l’HTAP des cardiopathies gauches et du rétrécissement mitral, laquelle est postcapillaire, consécutive à l’élévation des pressions de remplissage des cavités cardiaques gauches.
Retentissement cardiaque droit
L’HTAP peut entraîner, à la longue, un retentissement cardiaque droit :
- hypertrophie ventriculaire droite,
- puis dysfonction ventriculaire droite (systolique et/ou diastolique),
- enfin, signes cliniques d’insuffisance cardiaque droite :
- bruit de galop droit,
- souffle systolique d’insuffisance tricuspidienne,
- hépatomégalie douloureuse,
- œdèmes francs des chevilles.
-
L’évolution est plus rapidement défavorable dans les fibroses diffuses que dans les BPCO, où une survie prolongée est souvent observée.
La thérapeutique, sur laquelle nous allons revenir, a parfois transformé l’évolution et le pronostic : c’est en particulier le cas des cyphoscolioses sévères, traitées par ventilation nocturne, mais aussi des BPCO sous oxygénothérapie et des syndromes d’apnées traités par ventilation nasale nocturne + oxygénothérapie
-
Ventilation à domicile
-
La ventilation non invasive (VNI) par voie nasale a été appliquée avec succès dans les cyphoscolioses, mais aussi dans les affections neuromusculaires et dans les poussées aiguës des BPCO.
Il s’agit généralement d’une ventilation par pression positive intermittente.
Les appareils utilisés sont des respirateurs volumétriques, de type MONNAL D, ou des appareils à deux niveaux de pression (« bipap »), ou des appareils fournissant une aide inspiratoire.
Les cyphoscolioses et les affections neuromusculaires représentent les meilleures indications, l’objectif étant la mise au repos, pendant la nuit par exemple, des muscles respiratoires.
Nous nous limiterons aux aspects communs à toutes les IRC :
- la réhabilitation,
- le traitement médicamenteux de l’hypoxémie,
- l’oxygénothérapie de longue durée,
- la ventilation à domicile.
Réhabilitation respiratoire
L’objectif de la réhabilitation, qui comporte essentiellement les exercices respiratoires (« kinésithérapie » respiratoire), et le réentraînement à l’exercice, est de diminuer la dyspnée et la sensation d’angoisse qui lui est associée, d’augmenter les possibilités d’autonomie et d’améliorer la qualité de vie.
Même si les résultats objectifs (données fonctionnelles respiratoires, VO2 maximale) sont discutés, il est clair que la réhabilitation améliore la qualité de vie, en particulier des malades BPCO, du fait de l’augmentation de la capacité d’effort et de la tolérance à l’effort.
Elle est donc une partie intégrante du traitement de l’IRC.
Traitement médicamenteux de l’hypoxémie chronique
Le traitement médicamenteux prolongé de l’hypoxémie chronique, se limite à l’almitrine, car les analeptiques respiratoires (doxapram, progestérone) n’ont pas fait la preuve de leur efficacité en traitement au long cours [3].
Le bismésilate d’almitrine (Vectariont) améliore significativement l’hypoxémie des malades BPCO : amélioration moyenne de la PaO2 de 5−7mmHg après un an de traitement, mais il y a 25−30% de « non- répondeurs ».
Oxygénothérapie de longue durée (OLD)
Le seuil d’hypoxémie généralement requis pour l’OLD est une PaO2<55mmHg (deux mesures de la PaO2, au cours d’une période stable de la maladie, séparées par au moins 4 semaines)
La durée de l’OLD dans le nycthémère doit être > 16/24 heures et, si possible, > 18/24 heures.
D. Berdyev · R. Scapin · C. Labille · L. Lambin · M. Fartoukh © SRLF et Springer-Verlag France 2011
Définition, incidence et mortalité
La pneumonie aiguë communautaire (PAC) bactérienne est une infection du parenchyme pulmonaire d’évolution aiguë, acquise en milieu extrahospitalier ou à l’hôpital si elle survient
avant la 48e heure suivant l’admission .
Il s’agit de la maladie infectieuse la plus fréquente et potentiellement grave pouvant engager le pronostic vital.
L’incidence annuelle varie de 5 à 11 cas pour 1 000 habitants dans les pays occidentaux.
Selon le système de santé considéré, la proportion des patients adultes nécessitant une admission à l’hôpital varie de 22 à 50 % et celle des patients hospitalisés nécessitant une admission en réanimation de 10 à 36 %.
La mortalité est de l’ordre de 10 à 15 % chez les patients hospitalisés en médecine et de 25 enmoyenne jusqu’à 50 % chez les patients admis en réanimation.
Les facteurs associés à la mortalité en réanimation ou à l’hôpital sont
- l’âge,
- le sexe,
- la présence de comorbidités,
- certains paramètres radiocliniques et biologiques d’admission,
- les paramètres évolutifs des 48–72 premières heures,
- les données microbiologiques,
- le caractère bactériémique de la pneumonie
- et l’inadéquation de l’antibiothérapie initiale
Diagnostic clinique
Repose sur l’association
- de signes généraux (fièvre, malaise, frissons, myalgies)
- de signes respiratoires (dyspnée, douleur thoracique, toux, expectoration)
- des anomalies auscultatoires en foyer (râles crépitants).
La radiographie de thorax permet de confirmer la suspicion clinique et de différencier la pneumonie (opacités alvéolaires) d’une bronchite aiguë ou d’une exacerbation
de bronchopathie chronique obstructive (la radiographie thoracique est normale ou ne met en évidence que des anomalies en rapport avec la pathologie respiratoire préexistante).
Les principaux diagnostics différentiels sont
- l’oedème pulmonaire,
- l’embolie pulmonaire
- et les pneumopathies aiguës non infectieuses.
SCORE DE FINES
Investigations complémentaires « non invasives »
- L’examen direct de l’expectoration (ECBC) peut permettre une orientation étiologique rapide, s’il correspond bien à des sécrétions respiratoires provenant de l’arbre trachéobronchique et non pas de la cavité oropharyngée.
- L'aspiration bronchique (AB) « à l’aveugle » est sensible, mais soumise au même risque de contamination par les voies aériennes supérieures que l’ECBC
- deux paires d’hémocultures à une heure d’intervalle, si possible prélevées avant le début de l’antibiothérapie, sont suffisantes. Les hémocultures (très spécifiques) ne sont positives que dans 5 à 20%des cas, et le plus souvent positives à pneumocoque ;
- les méthodes d’identification des antigènes bactériens urinaires du pneumocoque et de L. pneumophila constituent des techniques rapides pour faire le diagnostic de pneumonie à pneumocoque (sensibilité 80–90 % dans les PAC bactériémiques et 50–65 % dans les PAC non bactériémiques) ou de légionellose (sérogroupe 1 ; sensibilité 85 % et spécificité proche de 100 %). À l’heure actuelle, la recherche d’antigènes dans le sang ou les urines des autres bactéries reste peu sensible et peu spécifique ;
- les sérologies sont en pratique, peu utiles (résultats retardés).
Investigations complémentaires « semi-invasives »
La fibroscopie bronchique permet non seulement de réaliser des prélèvements des sécrétions respiratoires distales de très bonne qualité dans le territoire de l’infection, à l’aide d’un prélèvement distal protégé (PDP), d’une brosse télescopique protégée ou d’un lavage bronchoalvéolaire (LBA)
Prélèvement respiratoire par cathéter distal protégé
OBJECTIF
Effectuer un prélèvement respiratoire pour culture quantitative des sécrétions distales, en évitant que ce prélèvement ne soit contaminé par les sécrétions des voies aériennes supérieures.
Le prélèvement bronchique par cathéter distal protégé peut être réalisé «à l’aveugle» ou dirigé sous fibroscopie bronchique.
MATERIEL NECESSAIRE
1) Matériel d’anesthésie
• locale (patients conscients non intubés ventilés)
– 1 tige laryngée, 1 seringue de 5 cc, 1 flacon de xylocaïne à 1% + 1 flacon de xylocaïne 5 % en spray pour l’anesthésie buccale et parfois un tube de xylocaïne visqueuse à 2 % et
seringue de 10 cc.
• générale (sédation ± curarisation sur prescription médicale chez les patients intubés ventilés)
2) Matériel pour le prélèvement bronchique par cathéter distal protégé
• combicath (Plastimed ou Ventimed).
• 1 paire de gants non stériles.
• 1 flacon stérile bouchon rouge.
• 1 seringue de 20 ml.
• 1 seringue de 2 ml + aiguille de prélèvement.
• 1 ampoule de sérum physiologique.
Si le PDP est réalisé sous fibroscopie:
Fibroscope relié à une source de lumière froide sur un charriot toujours disponible dans la réanimation. Silicone en aérosol pour lubrifier le fibroscope.
Matériel à aspiration (bocal+poche) relié à une source de vide.
Mettre un cale dents afin d’éviter d’abîmer le fibroscope.
Lubrifier le fibroscope.
TECHNIQUE
• Lavage simple des mains ou friction hydroalcoolique.
• Chez les patients en ventilation spontanée: adapter l’oxygenothérapie selon l’oxymétrie de pouls et l’état clinique du patient.
• Chez les patients intubés ventilés ou sous VNI: régler la FiO2 du ventilateur à 100% et le niveau de PEEP minimum (si possible); régler les alarmes de pression et de volume.
• Si le PDP est réalisé à l’aveugle: Effectuer une toilette de l’oropharynx et de la trachée avec une sonde d’aspiration.
Introduire le double cathéter (protégé par la sonde) et pousser l’ensemble jusqu’à être en butée dans une bronche (environ 20 à 30 cm). Retirer alors de 2 à 3 cm.
• Si le PDP est réalisé sous fibroscopie: Aspirer le patient avant l’examen pour éviter la contamination du fibroscope.
Le médecin introduit le fibroscope siliconé par le nez ou la bouche (cale dent) ou la sonde d’intubation (cale dent).
• Introduire le double cathéter (protégé par la sonde) dans le canal opérateur du fibroscope.
• Le médecin positionne le double cathéter dans la bronche incriminée.
• Pousser le cathéter interne de quelques centimètres jusqu’à ce qu’il soit lui-même en butée, et retirer le guide interne du cathéter.
• Réaliser 2 à 3 aspirations successives à travers le cathéter interne par une seringue vide de 20 ml montée sur celui-ci.
Si l’aspiration s’avère difficile (sensation de vide), retirer un peu l’ensemble de 1 à 2 cm.
• Après aspiration, retirer le cathéter interne d’une dizaine de cm, à l’intérieur du cathéter externe, en maintenant celui-ci en place.
• Retirer l’ensemble du système de prélèvement de la sonde d’intubation en laissant la seringue montée.
• Après aspiration, retirer le cathéter interne d’une dizaine de cm, à l’intérieur du cathéter externe, en maintenant celui-ci en place.
• Retirer l’ensemble du système de prélèvement de la sonde d’intubation en laissant la seringue montée.
• Couper l’extrémité (environ 5 cm) du cathéter externe avec le ciseau fourni dans le kit et jeter l’extrémité sectionnée.
• Pousser le cathéter interne pour en faire apparaître l’extrémité.
• Mettre 1 ml de sérum physiologique dans la seringue et pousser sur la seringue pour purger l’extrémité du cathéter dans le tube stérile.
• Les cinq derniers cm du cathéter interne sont sectionnés et placés dans le tube stérile, qui est transmis au laboratoire de Bactériologie pour examen direct et culture quantitative.
• Le prélèvement peut éventuellement être conservé au réfrigérateur jusqu’au lendemain matin, s’il a été réalisé de garde.
Surveillance: pouls, PA, FR, SpO2, cyanose, sueurs, alarmes du ventilateur (pression, volume)
Lavage broncho-alvéolaire (LBA)
OBJECTIF
Effectuer un prélèvement respiratoire du poumon profond pour culture quantitative des sécrétions bronchiques distales, en évitant que ce prélèvement ne soit contaminé par les sécrétions des voies aériennes supérieures pour permettre une analyse bactériologique
mais aussi anatomo-pathologique, immunologique, parasitologique, et virologique si nécessaire. Le LBA est réalisé sous fibroscopie bronchique.
MATERIEL NECESSAIRE
1) Matériel d’anesthésie
• locale (patients conscients non intubés ventilés)
– 1 tige laryngée, 1 seringue de 5 cc, 1 flacon de xylocaïne à 1% + 1 flacon de xylocaïne 5 % en spray pour l’anesthésie buccale et un tube de xylocaïne visqueuse à 2 % et seringue
de 10 cc
• générale (sédation curarisation sur prescription médicale chez les patients intubés ventilés)
Matériel pour le L.B.A
• 1 prolongateur de tubulure de 25 cm avec robinet.
• 1 pot stérile de 180 ml bouchon rouge pour mélanger le LBA.
Plusieurs pots pour les différents laboratoires (attention 1 pot conique type BK pour les analyses cytologiques)
3 à 4 seringues de 50 ml remplies de serum salé isotonique maintenu à température ambiante ou chauffé à 37°C.
Fibroscope relié à une source de lumière froide sur un charriot toujours disponible dans la réanimation. Silicone en aérosol pour lubrifier le fibroscope.
Matériel à aspiration (bocal+poche) relié à une source de vide.
Mettre un cale dents afin d’éviter d’abîmer le fibroscope. Lubrifierle fibroscope.
TECHNIQUE
• Lavage simple des mains ou friction hydroalcoolique
• Chez les patients en ventilation spontanée : adapter l’oxygenothérapie selon l’oxymétrie de pouls et l’état clinique du patient. Effectuer une toilette de l’oropharynx et de la trachée
avec une sonde d’aspiration.
• Chez les patients intubés ventilés ou sous VNI: régler la FiO2 du ventilateur à 100% et le niveau de PEEP minimum (si possible); régler les alarmes de pression et de volume.
Aspirer le patient avant l’examen pour éviter la contamination du fibroscope.
• Introduction du fibroscope siliconé par le nez ou la bouche ou la sonde d’intubation
• Injection de 1 à 2cc de xylocaïne à 1% par le canal opérateur à l’aide de la seringue de 5cc par l’IDE à la demande du médecin
• Positionnement dans la bronche incriminée (en cas de pneumonie diffuse: lingula ou lobe moyen).
• Une fois le fibroscope positionné, retirer le système d’aspiration; mettre le bouchon de lavage; relier le prolongateur de la tubulure à la première seringue de 50 cc de serum physiologique et le placer au niveau du canal opérateur du fibroscope, après avoir décapsulé la valve.
• Injecter lentement le serum puis le réaspirer. Ne jamais forcer pendant l’aspiration, si résistance, relâcher légèrement la pression puis reprendre doucement.
• Répéter cette opération pour les autres seringues prérempliesde serum isotonique.
• En cas d’échec de réaspiration, la procédure est interrompue après l’injection de deux seringues (soit 100 ml).
• Comptabiliser la quantité de serum administrée et recueillie dans les seringues et verser dans le pot de 180 ml.
• Mélanger délicatement.
• Répartir le liquide de lavage dans les différents pots selon les
examens demandés.
Surveillance: pouls, PA, FR, SpO2, cyanose, sueurs, alarmes du ventilateur (pression, volume)
Introduction
Il convient de distinguer
- les bronchites (et les bronchiolites),
- les pneumonies (bactériennes, virales, et plus rarement parasitaires ou fongiques),
- et les suppurations pleuro-pulmonaires ;
d’un point de vue pragmatique, il est plus habituel de distinguer parmi les pneumonies, les pneumonies communautaires, nosocomiales et de l’immunodéprimé
1. Bronchites
D’origine virale ou viro-bactérienne, et bénignes.
Elles ont un potentiel de gravité :
- aux âges extrêmes de la vie ;
- par une diffusion éventuelle des lésions aux bronchioles ;
- par leur survenue chez l’insuffisant respiratoire ou cardiaque ;
- par les séquelles (rares) qu’elles peuvent entraîner (bronchectasies, bronchiolite oblitérante).
1.1 - Définition
Conséquence d’une inflammation aiguë (souvent descendante, rhino-pharyngo-laryngo-trachéo-bronchique), en général par des virus qui détruisent les cellules ciliées de l’épithélium bronchique et provoquent une hypersécrétion de la muqueuse.
L’inhibition des processus de défense anti-inflammatoire par les virus peut aboutir à une surinfection bactérienne, surtout sur certains terrains (patient âgé, bronchitique chronique, alcoolisme...).
Les principaux germes de surinfection sont
- Haemophilus influenzae
- et Streptococcus pneumoniae.
1.2 - Aspects cliniques
1.2.1 - Bronchite aiguë virale de l’adulte sain
Signe d’appel principal : la toux (quinteuse, rauque, douloureuse, incessante, insomniante).
Souvent précédée d’une atteinte des voies aériennes supérieures (coryza, pharyngite avec dysphagie, laryngite).
Initialement non productive (sèche), s’accompagnant d’une sensation de cuisson rétro-sternale pénible, elle devient productive en quelques jours avec une expectoration muqueuse ou muco-purulente parfois striée de sang.
La fièvre atteint rarement 39 ° c.
Elle s’accompagne du cortège des signes d’une infection virale (céphalées, myalgies, arthralgies, asthénie, troubles digestifs).
L’examen révèle des ronchi et des sibilants.
Les examens complémentaires ne sont pas justifiés.
L’évolution est bénigne, avec une disparition progressive de la toux dans un délai de deux semaines.
Celle-ci peut persister plus longtemps (jusqu’à 3 mois), temps nécessaire à la cicatrisation complète des abrasions épithéliales post-virales.
1.2.2 - Formes cliniques
Selon l’agent causal (Plus de 180 virus ont été répertorié)
|
Virus |
Bactéries |
|---|---|
|
Influenza A et B |
Haemophilus influenzae |
|
|
|
|
Tabac - Pollution atmosphérique et industrielle |
|
Selon l’évolution
- En dehors d’un terrain fragilisé, une évolution grave compliquée d’une détresse respiratoire aiguë par bronchiolite ou pneumopathie extensive est exceptionnelle. Elle peut se voir au cours d’épidémies de grippe ou d’infections à virus respiratoire syncytial.
Selon le terrain
- L’âge, les maladies chroniques favorisent la surinfection bactérienne, le risque de pneumonie et d’insuffisance respiratoire aiguë.
- La bronchite aiguë d’origine infectieuse est responsable de la majorité des exacerbations de bronchite chronique et de broncho-pneumopathie chronique obstructive (BPCO)
- Chez l’asthmatique, l’insuffisant respiratoire chronique (restrictif ou obstructif) ou en cas d’insuffisance cardiaque, la bronchite aiguë peut être à l’origine d’une décompensation.
1.2.3 - Le nourrisson et l’enfant
Pas de particularités sauf : la bronchiolite et la coqueluche
La bronchiolite aiguë désigne un état pathologique en relation avec des lésions inflammatoires spécifiques de la bronchiole, en règle chez un enfant de moins de 2 ans.
1.3 - Traitement
1.3.1 - Bronchite aiguë de l’adulte sain
Traitement est symptomatique
1.3.2 - Exacerbation de bronchite chronique (EABC)
L’antibiothérapie est significativement plus efficace quand sont réunis les trois signes suivants:
- Une majoration de la dyspnée,
- Une augmentation du volume de l’expectoration,
- Une purulence des crachats (exacerbation de type I d’anthonisen). La purulence des crachats d’apparition ou d’aggravation récente est le meilleur signe d’orientation bien que non spécifique d’une infection bactérienne.
1.3.3 – La bronchiolite du nourrisson
La Société de pathologie infectieuse de langue française a proposé à l’issue d’une Conférence de consensus des recommandations suivantes figurant sur le tableau.
|
|
Première intention |
Evolution |
|---|---|---|
|
Bronchite aiguë du sujet sain |
Pas d’antibiotiques |
|
|
EABC sans SVO |
Pas d’antibiotiques |
Si échec à partir de J5 |
|
EABC |
amoxicilline |
Si ATB récente pour EABC : |
|
EABC . |
amoxicilline + acide clavulan |
Si échec ou si Pseudomonas spp : |
|
EABC : exacerbation aiguë de bronchite chronique |
||
Le traitement est symptomatique :
- position proclive dorsale,
- désobstruction nasale avec aspiration de sécrétions nasopharyngées,
- oxygénation éventuelle (par les lunettes nasales),
- kinésithérapie respiratoire fondamentale biquotidienne,
- hydratation insuffisante
MDT: ß2+ controversés, corticothérapie indiquée dans les formes trainantes avec hyperréactivité bronchique, antibiothérapie en cas de surinfection bactérienne
2. Pneumonies
Définition
La symptomatologie, les agents pathogènes en cause, les modalités de la prise en charge diagnostique et thérapeutique opposent les pneumonies communautaires et les pneumonies nosocomiales.
Le terme de pneumonie communautaire, traduction littérale de la locution community acquired pneumonia, a été consacré par l’usage et désigne l’ensemble des pneumonies contractées en milieu citadin et rural, hors de structures de soins.
A l’opposé, une pneumonie nosocomiale est une pneumonie contractée à l’occasion d’un séjour dans un établissement de soins, se manifestant au delà de 72 heures après l’admission.
2.1- Pneumonies communautaires
1 % de l’ensemble des infections respiratoires
Hospitalisation de 15 à 20 %
Mortalité
- 0 et 5 % pour les formes les moins sévères, (traitées au domicile) ;
- 10 et 20 % pour les formes graves hospitalisées
|
Pneumonies communautaires |
Pneumonies nosocomiales |
|---|---|
|
Fréquents |
|
|
Streptococcus pneumoniae |
Staphylocococcus aureus |
|
Rares |
|
|
Staphylococcus aureus
|
Streptococcus pneumoniae |
-
Les principales formes anatomo-cliniques
-
Pneumonie franche alvéolaire aiguë
Pneumonie interstitielle
localisée (atypique ou hilifuge)
diffuse
Bronchopneumonie
Formes mixtes, composites
Pneumonie d'aspiration
-
Les principaux diagnostics différentiels
Tuberculose pulmonaire
Embolie pulmonaire
Poumon cardiaque
Cancer broncho-pulmonaire
Pneumopathie immuno-allergique
2.2 - Aspects cliniques
De manière schématique, la pneumonie peut revêtir trois tableaux anatomo-cliniques
2.2.1 - la pneumonie alvéolaire systématisée: début brutal (horaire)
ou survenant après un à deux jours d’indisposition, + fièvre à 40° C, un malaise général intense, un point de côté bloquant la respiration, une toux sèche, une dyspnée progressive. L’examen clinique, pauvre dans les premières heures, est riche au 2ème ou 3ème jour.
2.2.2 - la pneumonie interstitielle:
début plus progressif, souvent précédée d’une infection rhino-pharyngée, avec un cortège de signes fonctionnels riches (toux, douleurs thoraciques, céphalées, myalgies), un examen clinique pauvre. Elle peut revêtir en fonction de la diffusion des signes deux aspects : soit celui de la pneumonie atypique ou pneumonie hilifuge; soit les signes sont plus étendus, sous la forme d’opacité réticulaires et micronodulaires bilatérales. C’est souvent le tableau d’une pneumopathie virale ou à germe intra-cellulaire (Mycoplasma pneumoniae, Chlamydia pneumoniae).
2.2.3 - la bronchopneumonie:
Elle est la conséquence d’une bronchio-alvéolite caractérisée par un début souvent brutal ou en deux temps après une phase de bronchite aiguë. La fièvre est désarticulée ou en plateau ; les signes généraux intenses ; l’expectoration purulente et abondante ; la dyspnée marquée.
L’entité pneumonie d’aspiration est caractérisée par un tableau généralement torpide, à l’occasion d’un trouble de déglutition passager (alcoolisme aigu, intervention sur les voies aériennes supérieures, anesthésie) ou chronique (paralysie du voile, sénilité). Elle siège en règle dans les zones déclives, elle est rapidement abcédée, les agents les plus communément en cause sont des entérobactéries, Staphylococcus aureus et surtout des germes anaérobies.
2.3 – Traitement
Le traitement antibiotique au cours d’une pneumonie communautaire prise en charge au domicile est probabiliste, empirique, en raison des difficultés du diagnostic microbiologique. En cas d’hospitalisation , surtout s’il s’agit d’une forme grave d’emblée ou aggravée, des investigations microbiologiques doivent être effectuées.
Le germe n’est pas identifié
Le repos au lit, une bonne hydratation, l’administration d’aspirine et d’un anti-inflammatoire non hormonal à visée antipyrétique et antalgique constituent le traitement de base de tous les malades. La présence de signes d’insuffisance respiratoire est une indication à l’oxygénothérapie (à la sonde nasale ou au masque) et à l’hospitalisation. La persistance sous oxygène d’une hypoxie inférieure à 60 mmHg est une indication à la ventilation assistée. Le choix probabiliste de l’antibiotique repose sur quelques principes :
aucun antibiotique actuellement disponible n’a un spectre et une tolérance tels qu’il puisse être un traitement de référence exclusif ;
en présence d’une pneumonie alvéolaire, l’antibiothérapie de première intention doit être active sur S. pneumoniae ;
le choix d’une antibiothérapie de spectre élargi ou d’une association de deux antibiotiques en première intention dépend de la gravité symptomatique et de facteurs de co-morbidité ou de maladies chroniques susceptibles d’élargir l’éventail des micro-organismes présumés en cause ;
l’antibiothérapie de deuxième intention doit combler les lacunes de spectre du traitement antibiotique initial inefficace ;
|
Antibiothérapie de première intention |
Absence d’amélioration à 48 heures |
|---|---|
|
≥ 40 ans Amoxicilline ( 1 g x 3/24 h) |
Macrolide (substitution ou association ) ou quinolone à visée antipneumococcique per os (monothérapie) |
|
< 40 ans Macrolide (sauf azithromycine) |
Amoxicilline (substitution ou association) |
-
Pneumonie communautaire, adulte ambulatoire, avec comorbidités, sans signe de gravité (âge > 65 ans et/ou comorbidités et/ou éthylisme chronique) Premier choix
Alternative
Cas général
amoxicilline-acide clavulanique
1 g x 3/24 h, per osCeftriaxone 1 g/24 h IV/IM
Suspicion d’intra cellulaire
et apparentés (légionellose)[amoxicilline-acide clavulanique
1 g x3/24 h, per os + macrolide]
ou [amoxilline + ofloxacine][ceftriaxone 1 g/24 hIV/IM + macrolide] ou [quinolone à visée antipneumococcique per os]
Suspicion d’inhalation
amoxicilline-acide clavulanique
1 g x 3/24 hC3G injectable (ceftriaxone 1 g/24 h parentéral IV/IM) + métrodinazole
|
|
Premier choix |
Alternative |
|---|---|---|
|
Cas général |
amoxicilline-acide clavulanique 1 g x 3/24 h, per os |
C3G parentérale (ceftriaxone 1 g/24 h céfotaxime 1 g/8 h) |
|
Suspicion cellulaire et apparentés (légionellose) |
[amoxicilline-acide clavulanique 1 g x3/24 h, per os + macrolide] ou [amoxilline + ofloxacine] |
[C3G parentérale (ceftriaxone 1 g/24 d’intra céfotaxime 1 g/8h) + macrolie ] ou [quinolone à visée antipneumococcique orale ou injectable] |
|
Suspicion d’inhalation |
amoxicilline-acide clavulanique |
C3G injectable (ceftriaxone 1 g/24 h, |
|
|
Premier choix |
Alternative |
|---|---|---|
|
Cas général |
[amoxicilline-acide clavulanique IV* injectable ou C3G injectable |
|
|
Si suspicion de Legionella |
+ rifampicine IV |
|
|
* Il est possible de recourir à une posologie de 1 à 1,5 g/4-6 h chez l’adulte par voie intraveineuse (correspondant à 100 à 150 mg/kg d’amoxicilline) |
||
|
|
Premier choix |
Alternative |
|---|---|---|
|
Cas général |
[amoxicilline-acide clavulanique IV* injectable ou C3G injectable |
|
|
Si suspicion de Legionella |
+ rifampicine IV |
|
|
* Il est possible de recourir à une posologie de 1 à 1,5 g/4-6 h chez l’adulte par voie intraveineuse (correspondant à 100 à 150 mg/kg d’amoxicilline) |
||
2.2 Pneumonies Nosocomiale
Mortalité atteint 20 à 50 %.
Les pneumonies nosocomiales précoces (dans les 5 premiers jours de l’hospitalisation) sont habituellement dues à des bactéries du milieu extra-hospitalier (S. Pneumoniae, H. Influenzae, S. Aureus méthicilline sensibles) ;
En revanche les pneumonies nosocomiales tardives sont dues à des germes sélectionnés par les antibiotiques, multirésistants ; elles sont souvent polymicrobiennes (S. Aureus méticilline résistant, P. Aeruginosa , entérobactéries).
Le diagnostic est suspecté sur l’existence d’une fièvre, de sécrétions trachéo-bronchiques purulentes, d’une image radiologique nouvelle ou aggravée.
Confirmé par l’examen bactériologique des sécrétions bronchiques
| Intrinsèques | Extrinsèques (en relation avec l’AMAR) |
|
|
D. Chatellier, S. Chauvet, R. Robert∗ Service de réanimation médicale, CHU de Poitiers, 2, rue de la Milèterie, 86021 Poitiers cedex, France J. Morel, C. Auboyer, R. Jospe, R. Terrana, S. Molliex 2010
Définition*
*2009 Société de réanimation de langue française. SRLF.
La pneumonie d’inhalation est définie par l’inhalation de contenu gastrique ou oropharyngé dans le larynx ou les voies aériennes inférieures.
Elle est liée à quatre mécanismes qui peuvent être associés :
- retard à la vidange gastrique,
- hypersécrétion gastrique,
- facteurs favorisant le reflux gastro-œsophagien
- et atteinte laryngée lésionnelle ou réflexe.
Elle survient essentiellement chez des malades ayant une altération de la conscience.
Les conséquences cliniques des inhalations sont variables et dépendent de la nature, du pH et du volume des sécrétions inhalées.
Les bactéries associées aux pneumopathies d’inhalation ont une origine oropharyngée.
Les mesures préventives ont surtout été étudiées au cours de l’anesthésie chez les patients ayant l’estomac plein.
Elle a été décrite par Mendelson en 1946 à partir d’une série de 61 patientes d’obstétrique ayant inhalé leur contenu gastrique lors de l’anesthésie à l’éther
En fait, sous le terme de PI, plusieurs syndromes sont possibles selon la quantité et surtout la nature du liquide inhalé .
- Il peut s’agir d’inhalation de liquide gastrique acide stérile réalisant une pneumonie chimique et correspondant au syndrome décrit par Mendelson (traduit en anglais comme « aspiration pneumonitis »).
- Il peut également s’agir de l’inhalation des sécrétions oropharyngées colonisées ou infectées par des bactéries (traduit en anglais comme « aspiration pneumonia »).
Ce dernier mécanisme est actuellement le plus fréquent.
La distinction entre les deux entités est parfois difficile et des formes mixtes sont possibles.
Passe souvent inaperçue
Pour Neelakanta (Neelakanta G Chikyarappa A. A review of patients with pulmonary aspiration of gastric contents during anesthesia reported to the Departmental Quality Assurance Committee. J Clin Anesth 2006;18: 102-7)
L’inhalation est certaine lorsqu’...
- elle est visualisée
- et que du liquide gastrique est aspiré de l’arbre trachéobronchique.
L’inhalation est probable lorsque...
- du liquide gastrique est présent dans les voies aériennes supérieures ou la bouche,
- qu’a été constaté un épisode périopératoire d’hypoxie (SpO2 < 90 %) avec ou sans sibilance
- et qu’apparaissent sur une radiographie pulmonaire postopératoire des modifications radiologiques hautement compatibles avec une inhalation gastrique.
Pour Warner ( Warner MA,Warner ME,Weber JG. Clinical significance of pulmonary aspiration during the perioperative period. Anesthesiology 1993;78: 56-62.)
L’inhalation est reconnue par la présence de sécrétions biliaires ou de particules solides visualisées à l’intérieur de l’arbre trachéobronchique.
Pour les patients chez qui cette donnée n’est pas disponible, l’apparition d’un infiltrat radiologique pulmonaire est nécessaire.
Les PI sont au cinquième rang des effets indésirables survenant au cours de l’anesthésie générale, en particulier sur estomac plein, l’incidence des PI est d’un pour 2000 à 4000 anesthésies chez l’adulte et d’un pour 1200 à 2600 chez l’enfant
Une étude rétrospective rapporte que la majorité des inhalations en périopératoire surviennent lors de la laryngoscopie ou de l’extubation avec une fréquence de l’ordre de 1 pour 3200 anesthésies et une mortalité d’un pour plus de 70 000.
Facteurs de risque d’inhalation.
Retard à la vidange gastrique
- Traumatisme
- Spasme du pylore
- Ileus
- Médicaments ralentisseurs du transit (morphiniques, sédatifs)
Hypersécrétion gastrique
- Douleur, stress
Facteurs favorisant le reflux gastro-oesophagien
- Reflux oesophagien
- Hernie hiatale
- Obésité*
- Neuropathie diabétique avec dysautonomie *
Facteurs laryngés
- Intubation en préhospitalier
- Anesthésie générale
- Chirurgie urgente
- Traumatisme crânien
- Atteinte neuromusculaire
- Sclérose en plaque
- Parkinson
- Guillain-Barré
- Paralysie des nerfs crâniens
- Dystrophies musculaires
*Facteurs discutés.
Facteurs de risque d’inhalation lors de l’induction de l’anesthésie*
*SakaiT, Planinsic RM, Quinlan JJ, Handley LJ, KimTY, Hilmi IA. The incidence and outcome of perioperative pulmonary aspiration in a university hospital: a 4-year retrospective analysis. Anesth Analg 2006; 103:941-7.Kluger MT, Short TG. Aspiration during anaesthesia: a review of 133 cases from the Australian Anaesthetic Incident Monitoring Study (AIMS). Anaesthesia 1999;54:19-26..
- Urgence
- Anesthésie insuffisante
- Position de Trendelenburg
- Pathologie gastro-œsophagienne
- Antécédents de chirurgie œsophagienne
- Analgésie morphinique
- Intubation difficile
- Ventilation au masque
- Obésité et antécédents de chirurgie bariatrique
- Syndrome occlusif
- Dysfonction gastro-intestinale
- Prise alimentaire récente
- Troubles de la déglutition
Physiopathologie
Les mécanismes physiopathologiques en cause dans les PI dépendent de la nature du liquide inhalé et donc du type de PI
|
Type de liquide inhalé |
Liquide gastrique acide |
Sécrétions oropharyngées infectées |
|
Mécanisme d’atteinte pulmonaire |
Lésions pulmonaires aiguës toxiques |
Inflammation pulmonaire aiguë en réponse à l’inoculation bactérienne |
|
Microbiologie |
Stérile au départ Possibilité de surinfection secondaire |
Cocci Gram positif Bacilles Gram négatif Anaérobies |
|
Facteurs de risque |
Altération marquée de la conscience |
Dysphagie, troubles de la motilité gastrique |
| Âge |
Pas d’influence de l’âge |
Sujets âgés le plus souvent |
| Clinique |
Inhalation souvent constatée par un témoin Tous les intermédiaires entre : asymptomatique, toux, bronchospasme, expectoration sanglante, détresse respiratoire aiguë dans les deux à cinq heures suivant l’inhalation |
Inhalation rarement constatée Polypnée, toux, signes de pneumopathie infectieuse |
Régurgitations et vomissements
Pression du sphincter oesophagien (PSO) ≈ 15 à 25 mmHg,
La pression intragastrique (PIG) normale < à 7 mmHg.
La PIG peut augmenter au-delà de 25 mmHg en position couchée ou lors d’une distension.
SI PIG > à PSO = régurgitation, phénomène passif.
En anesthésie, PI de régurgitations ; 3 FOIS PLUS fréquents que vomissements
Rôle de l’acidité, du volume et de la nature du liquide inhalé
Ces 3 éléments déterminent la gravité des lésions pulmonaires
pH
En dessous d’un pH à 1,5 les lésions sont particulièrement graves,
entre 1,5 et 2,5 elles sont proportionnelles au volume inhalé
et au-delà d’un pH à 2,5 elles sont comparables à l’inhalation de sérum salé physiologique
Volume
Un important volume liquidien ainsi que des aliments solides en grande quantité ou de grosse taille peuvent être responsables d’un tableau initial d’asphyxie
La présence de particules alimentaires de petite taille, même dans un liquide à pH élevé, peut donner des réactions inflammatoires importantes similaires à l’inhalation de liquide acide mais plus localisées et d’apparition un peu retardée.
Nature du liquide inhalé
L’ inhalations de charbon activé, utilisé comme substance épurative en toxicologie , peut avoir de graves conséquences (bronchiolite oblitérante, évolution vers une fibrose pulmonaire)
La diffusion du liquide inhalé vers la périphérie pulmonaire se fait en quelques secondes. Si la base droite, du fait de la configuration anatomique de la bronche souche droite, est logiquement la plus exposée, la migration se fait en pratique en fonction de la posture du patient au moment où survient l’inhalation.
L’inhalation de liquide gastrique acide entraîne :
- une agression tissulaire directe, avec desquamation de l’épithélium bronchique, atteinte de l’épithélium alvéolaire, destruction du surfactant et dégénérescence des pneumocytes de type I et II ;
- une réaction inflammatoire, faisant intervenir les médiateurs habituels de l’inflammation (histamine, thromboxane, cytokines, interleukines, tumor necrosis factor [TNF], etc.) survient secondairement à l’agression locale, puis va ensuite intervenir à distance sur le reste du parenchyme pulmonaire et même sur l’ensemble de l’organisme. Une lésion directe relativement localisée peut ainsi être responsable d’une atteinte pulmonaire beaucoup plus extensive et d’un syndrome inflammatoire à réponse systémique ;
- très rapidement, un œdème interstitiel puis alvéolaire, de type lésionnel avec présence d’éléments cellulaires (hématies, polynucléaires, macrophages).
Ainsi, après une phase initiale variable, pouvant être assez discrète, la réaction inflammatoire va se développer vers la 2ème heure avec une évolution qui peut se faire en 48 heures vers la formation de membranes hyalines suivie d’une réaction fibroblastique interstitielle avec risque de fibrose .
Les particules alimentaires sont responsables de lésions bronchiolaires plus marquées, souvent obstructives, avec des réactions granulomateuses pouvant mettre plusieurs semaines pour disparaître, voire évoluer vers des lésions chroniques.
Complications infectieuses
Lors de l’inhalation d’un liquide gastrique acide (aspiration pneumonitis), habituellement stérile, l’inflammation est au premier plan des lésions observées.
Néanmoins, la contamination de ce liquide lors du passage oropharyngé, la gravité des lésions altérant les mécanismes de défense locaux et une éventuelle ventilation mécanique vont exposer le patient au développement secondaire d’une infection.
Lors d’une inhalation associée à une aspiration de liquide contaminé d’origine digestive ou oropharyngée (aspiration pneumonia), le risque infectieux est a priori présent d’emblée.
Aspects cliniques
Survenue de l’inhalation
Elle est plus ou moins évidente, parfois totalement occulte, ou au contraire d’emblée très aiguë.
- occulte : régurgitation au cours d’un coma, d’une anesthésie, d’une alimentation entérale, sans signe clinique significatif immédiat. On peut être amené à évoquer l’inhalation au décours d’une anesthésie avec aggravation pulmonaire secondaire inexpliquée;
- discrète : épisode de toux plus ou moins important, souvent atténué par une sédation en réanimation sous ventilation mécanique. C’est l’aspiration trachéale qui peut alors ramener un liquide d’aspect digestif ou évoquant le liquide de nutrition entérale ;
- plus évidente : régurgitation visualisée lors de l’intubation, vomissement extériorisé suivi d’une toux, d’une dyspnée sibilante, d’une cyanose passagère, d’une désaturation en oxygène ;
- aiguë : tableau asphyxique secondaire à une obstruction des voies aériennes par des particules alimentaires ou par une quantité liquidienne importante avec menace vitale à court terme.
Évolution secondaire
Dans un grand nombre de cas, l’inhalation reste silencieuse et sera même ignorée. En l’absence de symptômes dans les 2 heures qui suivent l’inhalation, l’évolution est le plus souvent simple ;
Il peut s’agir d’un tableau clinique et radiologique, initialement très inquiétant, mais qui s’amende en 24 à 48 heures. Il correspond généralement à l’inhalation, en grande quantité, d’un liquide gastrique clair à pH élevé ;
On peut, au contraire, observer une évolution rapide en quelques heures vers un œdème lésionnel dont la topographie déborde largement le territoire primitivement concerné et qui peut donner rapidement un tableau de syndrome de détresse respiratoire aiguë (SDRA) avec une hypoxémie importante, parfois une hypercapnie.
Même dans ces formes graves, une évolution favorable peut néanmoins survenir avec un bon pronostic fonctionnel à long terme ;
Elle peut se faire vers une complication infectieuse se traduisant par une pneumopathie classiquement située au niveau de la base droite mais en fait de localisation variable. La bactériologie est fonction des circonstances initiales. On peut observer des formes évolutives nécrotiques abcédées prolongées où le rôle des anaérobies est possible ;
On peut aussi observer des évolutions traînantes avec diminution de la compliance, hypercapnie, finalement résolutives en quelques semaines, souvent secondaires à des inhalations de particules alimentaires. Une évolution vers une fibrose irréversible est possible.
Traitement
Corticothérapie
N’ont pas fait leur preuve (les complications infectieuses seraient plus fréquentes.)
Antibiothérapie
Antibiothérapie empirique comprenant souvent une association bêtalactamine/inhibiteur des bêtalactamases
Prévention
Anesthésie
Dans de nombreux cas, l’inhalation peut être rattachée à une prise en charge inadaptée de l’anesthésie :
- sous-estimation du risque,
- absence d’intubation,
- non-utilisation d’une séquence rapide,
- non-application d’une pression cricoïdienne (manœuvre de Sellick).
Le risque existe aussi lors d’une sédation pour des procédures exploratoires ou interventionnelles qui implique une grande vigilance et des conditions rigoureuses (matériel disponible, surveillance et compétences immédiatement accessibles) , sédation parfois utilisée pour des manœuvres trop complexes ou trop longues .
Jeûne
Recommandations sur la pratique du jeûne avant anesthésie (recommandations de la Société scandinave d’anesthésie-réanimation [2005]).
- Les patients (adultes et enfants) peuvent boire des liquides clairs jusqu’à 2 heures avant une anesthésie générale ou régionale
- Les patients ne doivent pas prendre de nourritures solides 6 heures avant l’induction de l’anesthésie
- L’alimentation au sein doit être arrêtée 4 heures avant l’induction de l’anesthésie.
- La même précaution doit s’appliquer pour le lait en poudre
- Les adultes peuvent boire jusqu’à 150 ml d’eau avec une prémédication jusqu’à 1 heure avant l’induction de l’anesthésie, et les enfants jusqu’à 75 ml
- L’usage de chewing-gum et fumer doivent être évités durant les 2 heures avant l’induction de l’anesthésie
- Ces recommandations s’appliquent aussi aux césariennes programmées
- Les liquides clairs sont définis comme des liquides sans particule, sans graisse, par exemple, eau, jus de fruit sans pulpe, thé, café
- Le lait de vache et le lait en poudre sont considérés comme de la nourriture solide Les patients avec un retard connu ou suspecté de la vidange gastrique (diabète, pathologie gastro-intestinale haute) doivent être considérés sur des bases individuelles
Recommandations de l’American Society of Anesthesiologists (ASA, 2007)
- La prise orale de liquide clair en faible quantité peut être permise chez des patientes en travail simple
- Les patientes, sans complication, devant avoir une césarienne programmée peuvent prendre des liquides clairs en faible quantité jusqu’à 2 heures avant l’induction anesthésique. Exemple de liquide clair : eau, jus de fruit sans pulpe, boisson bicarbonatée, thé, café noir
- Le volume de liquide est moins important que la présence de particules
- Les patientes présentant un risque supplémentaire d’inhalation (obésité morbide, diabète, intubation difficile) ou un risque augmenté d’accouchement difficile (rythme cardiaque instable) peuvent avoir des restrictions supplémentaires de prise orale décidées au cas par cas
- L’ingestion de matières solides doit être évitée durant le travail
- Les patientes devant subir une césarienne programmée doivent observer un jeûne pour les matières solides de 6 à 8 heures dépendant du type de matière ingérée (matière grasse)
- Avant une procédure chirurgicale (césarienne), le médecin doit considérer l’opportunité de l’administration d’un antiacidenon particulaire, un anti H2 et/ou du métoclopramide
Augmentation du pH
Une seule dose de ranitidine ou d’inhibiteur de la pompe à sodium s’est montrée efficace pour augmenter le pH et diminuer le volume du liquide gastrique pendant toute la période opératoire .
Le citrate de sodium élève le pH en 2 minutes et le maintient au-dessus de 2,5 pendant 6 heures