COMPOSITION QUALITATIVE ET QUANTITATIVE
- Diazépam ..................................................................................0,500 g
- Propylèneglycol.........................................................................41,400 g
- Ethanol à 96 pour cent ..............................................................8,525 g
- Benzoate de sodium ................................................................4,750 g
- Acide benzoïque........................................................................0,250 g
- Hydroxyde de sodium ……………….......................................q.s.p. pH 6,5
- Alcool benzylique .....................................................................1,570 g
- Eau pour préparations injectables .............................................q.s.p. 100 ml
INDICATIONS THÉRAPEUTIQUES
Urgences neuropsychiatriques
- utraitement d’urgence de l’état de mal épileptique de l’adulte et de l’enfant,
- ucrise d'angoisse paroxystique,
- ucrise d'agitation,
- udelirium tremens.
Pédiatrie
- traitement d’urgence par voie rectale des crises convulsives du nourrisson et de l'enfant.
Anesthésie
- prémédication à l'endoscopie,
- induction et potentialisation de l'anesthésie.
Autre indication
- tétanos.
POSOLOGIE ET MODE D’ADMINISTRATION
Dose
- La posologie sera essentiellement dépendante de la situation clinique.
- Chez l’adulte elle varie de 0,1 à 0,2 mg/kg par injection.
- On peut d'emblée administrer 1 à 2 ampoules par voie IM ou IV lente.
- Cette dose pourra être renouvelée jusqu'à 4 fois par 24 heures, voire davantage en milieu hospitalier.
- Injection intra rectale dans le traitement de la crise convulsive du nourrisson et de l'enfant :
- La solution injectable est utilisée à la dose de 0,5 mg/kg de poids corporel (soit 0,1 ml de solution/kg), sans dépasser 10 mg.
- La quantité voulue est prélevée à l'aide d'une seringue et injectée dans le rectum à l'aide d'une canule adaptable à la seringue.
- Traitement d’urgence de l’état de mal épileptique du nourrisson et de l’enfant :
- nourrisson : 0,5 mg/kg
- enfant : 0,2 à 0,3 mg/kg
- Administration par voie IV lente.
- L’injection pourra être répétée 10 à 20 minutes après.
- Chez le sujet âgé, l’insuffisant rénal ou hépatique : il est recommandé de diminuer la posologie, de moitié.
- Etat de mal convulsif chez l’adulte : 2 mg/mn en perfusion intraveineuse rapide jusqu'à 20 mg puis perfusion lente avec 100 mg dans 500 ml de solution glucosée, à raison de 40 ml/heure
CONTRE-INDICATIONS
Ce médicament ne doit jamais être utilisé dans les situations suivantes :
- hypersensibilité au principe actif ou à l’un des autres constituants,
- insuffisance respiratoire sévère,
- syndrome d'apnée du sommeil,
- insuffisance hépatique sévère, aiguë ou chronique (risque de survenue d'une encéphalopathie),
- myasthénie.
PROPRIÉTÉS PHARMACOCINÉTIQUES
Distribution
- Distribution rapide (30 à 60 minutes)
- Volume de distribution varie de 1 à 2 l/kg.
- Clairance totale plasmatique après administration intraveineuse, est de 30 ml/min.
- La liaison aux protéines est importante, en moyenne de 95 à 98 %.
- La demi-vie d'élimination plasmatique du diazépam est comprise entre 32 et 47 heures. L'état d'équilibre des concentrations plasmatiques est atteint en une semaine au minimum.
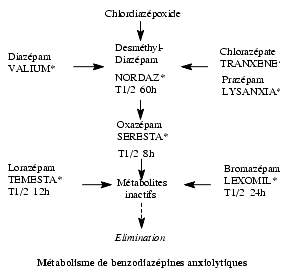
Métabolisme et Elimination
- Pourcentage négligeable (< 0,1 %) au niveau urinaire.
- Le métabolite principal du diazépam est le desméthyldiazépam, également actif, dont la demi-vie est plus longue que celle de la molécule-mère (entre 30 et 150 heures).
INCOMPATIBILITÉS
- Le mélange avec d'autres produits dans la même seringue est à proscrire.
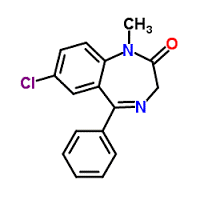
Présentation :
- Ampoules de 1ml 1 mg (1 mg/ml)
- Et : comprimés à 1 mg (rohypnol*).
Pharmacocinétique et métabolisme :
- Dégradation hépatique à 98% et élimination urinaire à 90% et 10% dans les selles
- Deux métabolites principaux dépourvus d'activité, les dérivés N-déméthylé (1/2t = 31 h) et 7-aminé (1/2t = 23 h) .
- Passe la barrière fœto-placentaire, hémato-encéphalique ainsi que le lait maternel .
- Demi-vie d'élimination = 19 à 30 heures chez l'adulte.
- 8 à 15 heures chez l'enfant.
- Délai d'action par voie I.V. = 2 à 3 mn.
- Durée d'action par voie I.V. : narcose : 30 mn
- sédation : 1 à 3 heures.
- Après administration IV de 2 mg de flunitrazépam (2 ampoules de Narcozep), on obtient des concentrations plasmatiques dont la courbe contient 3 parties :
- durant la première heure qui suit l'injection, la concentration plasmatique chute rapidement ; jusqu'à la 8e heure, c'est le flunitrazépam inchangé qui domine dans le plasma,
- ensuite ce sont ses métabolites.
- La liaison aux protéines est importante, ≈ 78 %.
Pharmacodynamie :
S.N.C .
- Effet hypnotique puissant fonction de la dose et d'installation lente.
- Anxiolytique avec diminution du tonus émotionnel.
- Pas d'effet analgésique.
- Action anticonvulsivante puissante.
- Amnésie complète couvrant les phases pré, per, et post-administration.
- Diminution du débit sanguin cérébral, de la pression de perfusion cérébrale, de la consommation d'oxygène du cerveau et de la pression intra-crânienne.
Cardio-vasculaire :
- Diminution modérée de la pression artérielle puis retour à la normale.
- Fréquence cardiaque peu modifiée.
- Diminution du débit cardiaque et du volume d'éjection systolique.
- Diminution de la consommation d'oxygène du myocarde.
Poumons :
- Dépression respiratoire d'origine centrale dose-dépendante avec diminution du volume courant et augmentation modérée puis diminution de la fréquence respiratoire.
- Diminution de la compliance pulmonaire.
- Apnée possible (en fonction de la dose et de la vitesse d'injection).
Divers :
- Action myorelaxante.
- Diminution de la pression intra-oculaire.
- Absence d'histamino-libération notable.
- Ralentissement du transit intestinal.
- Vasodilatation cutanée et hypothermie.
Indications :
- Prémédication.
- Agent d’induction, de potentialisation et d’entretien de l’anesthésie.
- Sédation en réanimation ; adaptation au respirateur (en l’absence d’un problème mécanique : défaut de réglage, encombrement bronchique...)
Posologie :
- Sédation :
- 0,5 à 1 mg/h. en administration continue.
- Anesthésie :
- Prémédication : 0,015 - 0,030 mg/kg en I.M. avant l'induction ou 1 mg per os 60 minutes avant l'induction
- Induction : 0,015 - 0,03 mg/kg en I.V.D. lente (le 1er mg en 30 sec.); (1 à 2 ampoules/75 kg).
- Dose d'entretien : 1/2 puis 1/3 de la dose initiale toutes les 45 à 60 mn.
- Enfant : 0,03 - 0,05 mg/kg.
- Diminuer les doses chez l'insuffisant hépatique, insuffisant cardiaque et sujet âgé.
Surdosage :
- Somnolence, coma avec dépression respiratoire ventilation assistée), hypotension.
- Antidote : flumazénil (Anexate*).
Interférences médicamenteuses :
- Majoration des effets des drogues dépressives du S.N.C (synergie additif).
- Morphinomimétiques : potentialisation et majoration de la dépression respiratoire.
- Diminue les myoclonies de l'hypnomidate.
- Diminue les hallucinations liées à la kétamine.
Effets indésirables :
- Hypotension artérielle et dépression respiratoire à l'induction surtout si injection rapide.
- Frissons au réveil.
- Intolérance veineuse, douleurs au point d'injection, thrombophlébites localisées.
- Obstruction si injection intra-artérielle accidentelle.
- Fatigue, somnolence, faiblesse musculaire, diminution des facultés intellectuelles.
- Toxicomanie : dépendance et accoutumance possible.
Contre-indications :
- Antécédents connus d'hypersensibilité aux BZD ou à l'un des composants..
- Absence de matériel de ventilation et d'aspiration.
- Myasthénie, myopathie, insuffisance hépatique sévère, insuffisance respiratoire sévère : risque de dépression respiratoire prolongée.
- Collapsus cardiovasculaire non corrigé.
- Enfant de moins de 3 ans en raison de la présence d'alcool benzylique
Présentation
Midazolam (sous forme de chlorhydrate)....................................... 1 mg/1 ml
Une ampoule de 5 ml contient 5 mg de midazolam.
Propriétés pharmacocinétiques
Absorption après administration par voie I.M.
- Après administration par voie intramusculaire, le midazolam est absorbé rapidement et complètement.
- Les concentrations plasmatiques maximales sont atteintes en 30 minutes.
- La biodisponibilité absolue est de plus de 90%.
Absorption après administration par voie rectale
- Après administration par voie rectale, le midazolam est absorbé rapidement.
- La concentration plasmatique maximale est atteinte dans les 30 minutes.
- La biodisponibilité absolue est d'environ 50%.
Métabolisme
- Le midazolam est presque entièrement éliminé par biotransfomation.
- La fraction de la dose extraite par le foie a été estimée à 30-60%.
- Le midazolam est hydroxylé par l'isoenzyme 3A4 du cytochrome P450 et le métabolite principal, urinaire et plasmatique est l'alpha-hydroxymidazolam.
- Les concentrations plasmatiques de l'alphahydroxymidazolam représentent 12% de celles de la molécule mère.
- L'alphahydroxymidazolam est pharmacologiquement actif, mais il ne contribue que faiblement (environ 10%) à l'effet du midazolam administré par voie intraveineuse.
Elimination
- Chez le volontaire sain, la demi-vie d'élimination du midazolam est comprise entre 1,5 et 2,5 heures.
- La clairance plasmatique se situe entre 300 et 500 ml/min.
- Le midazolam est éliminé principalement par voie rénale (60 à 80% de la dose administrée)
- Moins de 1% de la dose administrée est retrouvée sous forme inchangée dans les urines.
- La demi-vie d'élimination de l'alpha-hydroxymidazolam est de moins d'une heure.
- Lorsque le midazolam est administré en perfusion intraveineuse, sa cinétique d'élimination n'est pas différente de celle qui suit une administration en bolus.
|
t 1/2ß |
Clairance (ml/kg/min) |
Vdss (l/kg) |
|
| Diazépam | 20-50 | 0,2-0,5 | 0,7-1,7 |
| Dropéridol | 1,7-2-2 | 14 | 2,0 |
| Etomidate | 2,9-5,3 | 18-25 | 2,5-4,5 |
| Fentanyl | 2,5-5 | 5-15 | 3-5 |
| Flumazénil | 0,7-1,3 | 5-20 | 5-20 |
| Kétamine | 2,5-2,8 | 12-17 | 3,1 |
| Midazolam | 1,7-2,6 | 6,4-11 | 1,1-1,7 |
| Propofol | 4-7 | 20-30 | 2-10 |
|
Abréviations: t 1/2ß Délai d’action : 30 à 60 sec; t1/2 Keo= 2-3 min |
|||
Propriétés pharmacodynamiques
- Classe pharmacothérapeutique : HYPNOTIQUES ET SEDATIFS : dérivés des benzodiazépines.
- Solution pour injection stable et bien tolérée.
- L'action pharmacologique du midazolam est caractérisée par sa courte durée d'action due à une dégradation rapide.
- Le midazolam présente une action sédative et hypnotique intense.
- Il exerce également des activités anxiolytique, anticonvulsivante et myorelaxante.
- Après une administration par voie I.V. ou I.M. il apparaît une amnésie antérograde de courte durée (le patient ne se souvient plus des événements qui se sont produits lors de l'activité maximale du produit).
- Le profil pharmacodynamique est semblable à celui du Diazépam
Mode d’action
- Mode d’action bien connu
- Mécanismes des différents effets mal définis
- Hypnose
- Sédation
- Anxiolyse
- Relaxation musculaire
- Effets anticonvulsivants
- Action sur les récepteurs post-synaptiques
- Augmentation de l’inhibition pré synaptique
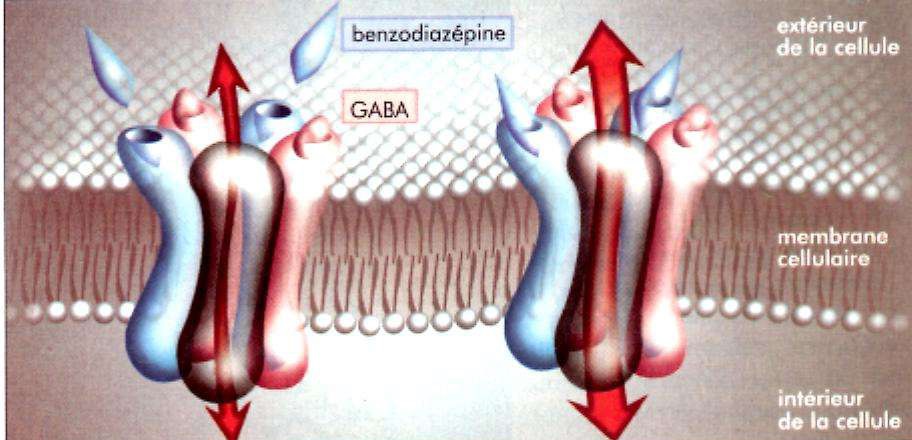
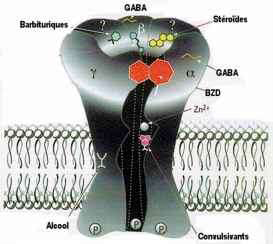
- Sensibilité aux BZD différents selon les zones cérébrales:
- Récepteurs de type I cérébelleux (anxiolyse)
- Type II cortex cérébral (sédation)
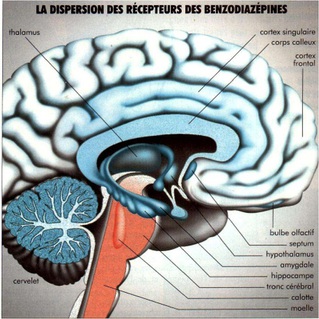
- Densité récepteurs:
- Forte: bulbe olfactif, cortex cérébral, cervelet, hippocampe, locus niger, collicus inférieur
- Faible: striatum, moelle, partie inf TC
- Modification de la conductance au chlore des récepteurs GABAergiques.
- Effet fonction du nobre de sites occupés
- Anxiolyse (20%) < relaxation < effet anticonvulsivant (60%)
- Ligands:
- Agonistes
- Agonistes inverses
- Antagonistes
Effets cardiovasculaire
- Discrète baisse RVS
- Veinodilatation et baisse du retour veineux
- Dépression transitoire du baroreflexe et du tonus sympathique
- Effet de l’hypovolémie
Effets respiratoires
- Dépression respiratoire dose et vitesse dépendantes (pas d’altération Co2 à 0,075 mg/kg).
- Aggravé si BPCO,âge (+longue et importante)
- Délai de le dépression respiratoire (0,15 à 0,2 mg/kg) est de 3 min
- Persistance jusqu’à 120 min (Gross Anesthesiology 1983)
- Effets synergiques avec morphiniques
- Apnées= thiopental : rôle prémédication et vitesse bolus
Effets sur le SNC
- Anxiolytique, hypnotique, anticonvulsivant, myorelaxant, amnésie antérograde
- Réduction du DSC de 35% par diminution CMRO2, dose dépendante
- E.E.G:
- Disparition rythme alpha, activité béta
- Réapparition en 30 min
- Protection cérébrale C/ < hypoxie, thiopental
INDICATIONS
Hypnotique et sédatif à action rapide dont les indications sont :
- Chez l'adulte & Enfant
- Sédation vigile, avant et pendant les procédures à visée diagnostique ou thérapeutique, avec ou sans anesthésie locale.
- Anesthésie
- Prémédication avant l'induction de l'anesthésie,
- Induction de l'anesthésie, (adulte seulement)
- Agent sédatif en association avec d'autres agents anesthésiques/analgésiques. (adulte seulement)
- Sédation en unités de soins intensifs.
CONTRE-INDICATIONS
- Hypersensibilité aux benzodiazépines
- Hypersensibilité à l'un des composants
- Insuffisance respiratoire sévère
| Indications |
Adultes <60 ans |
Adultes > ou = 60 ans ou adulte en mauvais état général ou adulte avec maladie chronique |
Enfants |
|---|---|---|---|
|
Sédation vigile |
|
|
|
|
Anesthésie prémédication |
|
|
|
|
Anesthésie induction |
|
|
|
|
Anesthésie agent sédatif en association avec d'autres agents anesthésiques/analgésiques |
|
|
|
|
Sédation en unités de soins intensifs |
|
|
BUT DE L’ANTAGONISATION
- Le flumazénil (Anexate) permet, au réveil d’une anesthésie générale, d’antagoniser les effets des benzodiazépines .
- Il est ici très efficace, mais en pratique peu utilisé dans cette indication.
- En effet, au cours des anesthésies générales ayant comporté une association benzodiazépines, morphiniques et anesthésiques volatils, le rôle des benzodiazépines dans la somnolence postopératoire n’est pas au premier plan.
- Cet antagoniste peut en revanche être utilisé à visée diagnostique dans le cadre d’un coma de cause incertaine, que ce soit en postopératoire ou dans le cadre des urgences.
PHARMACOCINÉTIQUE
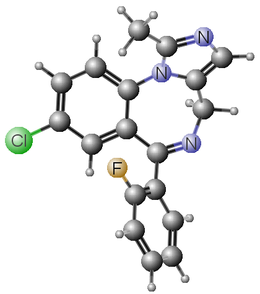
- Le flumazénil est une imidazo-benzodiazépine de pKa proche de 1,7.
- Il est présenté sous forme d’une solution intraveineuse en ampoule de 5 mL (0,5 mg) et de 10 mL (1,0 mg).
- Après administration intraveineuse, son volume de distribution est de 1 L/kg et sa demi-vie d’élimination est proche d’une heure.
- Cette demi-vie est plus courte que celle des benzodiazépines. Sa clairance plasmatique est proche du débit sanguin hépatique (1 L/min).
- Liposoluble, le flumazénil est fixé pour 50 % à l’ Ialbumine plasmatique. Il traverse facilement la barrière hémato-encéphalique.
- il est métabolisé à 99 % par le foie, en métabolites inactifs.
- Par voie orale, sa biodisponibilité est faible (16 %), en raison d’un important effet de premier passage hépatique.
- Le flumazénil ne modifie pas la pharmacocinétique des benzodiazépines, et vice versa.
PHARMACODYNAMIE
- Le flumazénil antagonise les effets des benzodiazépines en se liant de manière spécifique et réversible aux récepteurs des benzodiazépines, sans induire d’effet pharmacologique. Il s’agit donc d’un antagonisme spécifique.
- Son affinité pour ce récepteur est comparable à celle des principales benzodiazépines utilisées en anesthésie-réanimation.
- Le flumazénil antagonise l’ensemble des effets des benzodiazépines et semble dépourvu de toute action propre.
- Des phénomènes de tolérance aiguë peuvent survenir et expliquer certaines discordances entre l’antagonisme des effets hypnotiques et des effets ventilatoires .
- Quoi qu’il en soit, le flumazénil antagonise les effets dépresseurs respiratoires des benzodiazépines, même en réponse à une hypoxie ou une hypercapnie.
UTILISATION CLINIQUE
Au cours de l’anesthésie générale
- Après une anesthésie générale ayant utilisé des de flumazénil permet un retour rapide de la conscience (1 à 2 minutes), et la récupération d’une orientation temporospatiale satisfaisante en moins de 5 minutes.
- L’absence de réaction adrénergique et d’augmentation brutale de la consommation d’oxygène permet son administration chez des patients à risques, aux réserves cardiaques limitées Le flumazénil procure donc un réveil rapide, mais il ne permet pas de accourcir le séjour en SSPI.
- En effet, sa courte durée d’action rend possible un ré-endormissement qui peut s’avérer dangereux en l’absence de moyen de surveillance.
- Par ailleurs, on a pu établir que la dépression respiratoire des benzodiazépines n’était que transitoirement antagonisée par le flumazénil, surtout quand la benzodiazépine administrée a une demi-vie longue (flunitrazépam, diazépam).
- Pendant le réveil anesthésique, le flumazénil est contre-indiqué si l’anesthésie générale a comporté de la kétamine ou chez le sujet traité au long cours par des benzodiazépines (risque de sevrage aigu)
- En ambulatoire, le flumazénil est contre-indiqué, du fait du risque de ré-endormissement secondaire .
Utilisation diagnostique
- Le flumazénil peut-être administré pour obtenir un réveil transitoire à visée diagnostique, au cours de la chirurgie du rachis, après chirurgie de la carotide ou neurochirurgie.
- Il permet également d’éliminer une sédation aux benzodiazépines dans le diagnostic d’un coma (postopératoire ou dans le cadre des urgences).
UTILISATION PRATIQUE
- Le flumazénil doit initialement être administré par titration : injection initiale de 0,1 à 0,2 mg suivie de doses complémentaires de 0,1 à 0,2 mg toutes les 1 à 3 minutes, jusqu’à obtention de l’effet recherché.
- La durée de cet effet antagoniste dépend entre autres de la demi-vie du flumazénil, ainsi que de la dose et de la demi-vie de la benzodiazépine à antagoniser. Il faut le plus souvent administrer le flumazénil de façon prolongée, car sa demi-vie d’élimination est bien inférieure à celles des principales benzodiazépines.
- On recommande une perfusion continue à un débit compris entre 0,1 et 0,8 mg/h, pour une durée qui sera adaptée aux résultats cliniques.