1- Cliquez ici pour : Rappel physiologique de la plaque motrice🖱️.
1. INTRODUCTION
Le mouvement résulte de l'alternance de la contraction (rétrécissement) et du relâchement des musclesqui représente 40 et 50 % du poids corporel total.
La force musculaire est la principale fonction du muscle
la transformation de l'énergie chimique (d'ATP) en énergie mécanique afin de générer la force,d'accomplir un travail et de produire du mouvement.
La myologie (myo: muscle ; logie : étude de) est l'étude scientifique des muscles.
2.LES TYPES DE TISSU MUSCULAIRE
Les trois types de tissu musculaire- squelettique
- cardiaque
- lisse
- leur aspect microscopique,
- leur emplacement
- La régulation qu'exercent les systèmes nerveux et endocrinien.
2.1. Le tissu musculaire squelettique
Ainsi désigné, car rattaché aux os et déplace des parties du squelette. (Certains muscles squelettiques sont aussi rattachés à la peau, à d'autres muscles ou aux fascias profonds).Appelé aussi muscle strié, car au microscope il présente des bandes (stries) claires et foncées en alternance.
C'est un tissu musculaire volontaire: possible de le contracter ou de le relâcher consciemment.
2.2. Le tissu musculaire cardiaque
Également strié, mais involontaire,Renferme un système de régulation (pacemaker) qui fait battre le coeur.
Des modifications de la fréquence cardiaque sont possibles du fait que des hormones et divers neurotransmetteurs influent sur le régulateur.
2.3. Le tissu musculaire lisse
Situé dans les parois de structures internes creuses telles- Les vaisseaux sanguins,
- L'estomac,
- Les intestins
- La plupart des organes abdominaux.
- Dans la peau, rattachée aux follicules pileux.
Tissu musculaire involontaire, pourvu d'autorythmicité et influencé par quelques hormones et neurotransmetteurs.
3. LES FONCTIONS DU TISSU MUSCULAIRE
- Le mouvement.
- La stabilisation des positions du corps et la régulation du volume des organes.
- La génération de chaleur (thermogénèse).
4.LES CARACTÉRISTIQUES DU TISSU MUSCULAIRE
- L'excitabilité (irritabilité): l'aptitude à réagir à certains stimuli par la production de signauxélectriques appelés potentiels d'action.
- La contractilité est la propriété du tissu musculaire de pouvoir se raccourcir et s'épaissir (secontracter),
- L'extensibilité signifie que le muscle peut être étendu (étiré) sans endommager le tissu.
- L'élasticité est la propriété du tissu musculaire de reprendre sa forme initiale après unecontraction ou une extension.
5.L'ANATOMIE ET L'INNERVATION DU TISSU MUSCULAIRE SQUELETTIQUE
5.1. L'innervation et l'irrigation sanguine
Les neurones qui stimulent le muscle afin qu'il se contracte s'appellent les neurones moteurs.Contraction → ATP+++ → Nutriments et O2+++ → Déchets +++
L'action prolongée d'un muscle dépend donc d'une riche irrigation sanguine destinée à livrer les nutriments et l’O2 en plus d'évacuer les déchets et la chaleur.
5.2. Les composants de tissu conjonctif
- Le tissu conjonctif entoure et protège le tissu musculaire.
- Le fascia (fascia: bande) désigne une couche ou une large bande de tissu conjonctif fibreuxsituée sous la peau ou autour des muscles et d'autres organes du corps.
- Le fascia superficiel (la couche sous-cutanée) se trouve directement sous la peau. Il est composé
- De tissu adipeux
- De tissu conjonctif aréolaire.
- Le fascia superficiel remplit 4 fonctions importantes:
- il emmagasine de l'eau et de la graisse (chez une personne obèse, presque toute lagraisse se trouve dans le fascia superficiel),
- il forme une couche isolante qui empêche la perte de chaleur corporelle,
- il protège le corps des chocs extérieurs,
- il permet aux nerfs et aux vaisseaux sanguins d'entrer et de sortir des muscles.
- Le fascia profond est un tissu conjonctif dense irrégulier qui tapisse la paroi du corps et lesmembres.
- Il maintient les muscles ensemble et les sépare en groupes fonctionnels.
- Il permet le libre mouvement des muscles, transporte des nerfs de même que des vaisseauxsanguins et lymphatiques, et remplit les espaces entre les muscles.
5.3. L'unité motrice
Un neurone moteur transmet le stimulus qui provoque finalement la contraction d'une fibre musculaire.On appelle unité motrice l'ensemble formé par un neurone moteur et toutes les fibres musculaires que ce dernier stimule.
N.B; un seul neurone moteur peut entrer en contact avec 150 fibres musculaires Les muscles intervenantdans des mouvements précis (voix) contiennent à peine 2 ou 3 fibres musculaires par unité motrice lesmoins précis (biceps) jusqu'à 2 000 fibres par unité motrice.
5.4. La jonction neuromusculaire
Les cellules excitables communiquent dans des zones spécialisées appelées synapses. un petit espace appelé fente synaptique sépare les deux cellules excitables.La première cellule communique avec la suivante en libérant un produit chimique appelé neurotransmetteur.
Le type particulier de synapse formé entre un neurone moteur et une fibre musculaire squelettique est appelé la jonction neuromusculaire (JNM) ou jonction myoneurale.
Tout près de ses fibres musculaires squelettiques cibles, l'axone d'un neurone moteur se ramifie en groupes de terminaisons axonales bulbeuses.
La région de la membrane de la fibre musculaire adjacente aux terminaisons axonales possède des caractéristiques propres et est appelée plaque motrice.
Le terme jonction neuromusculaire couvre à la fois les terminaisons axonales du neurone moteur et la plaque motrice de la fibre musculaire.
5.5. L'anatomie microscopique du muscle
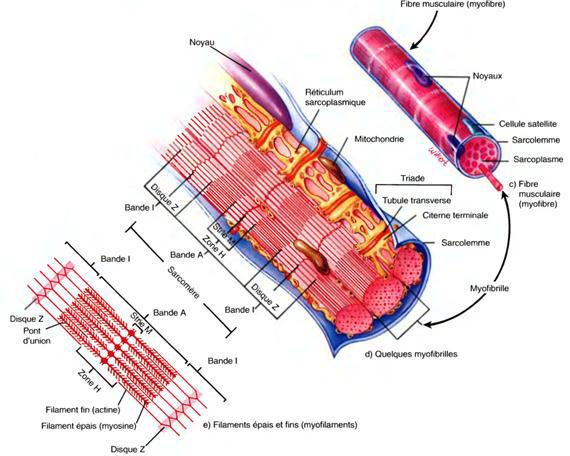
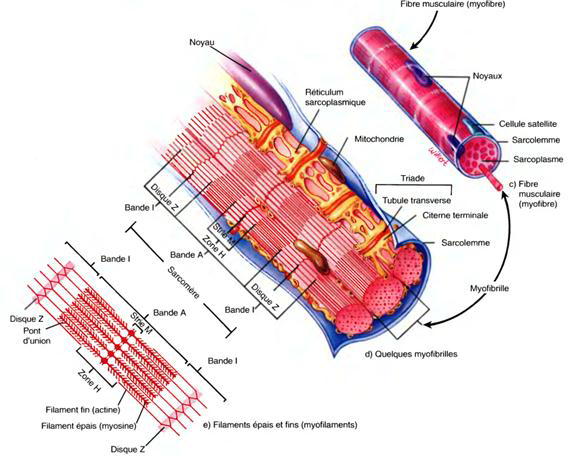
L'examen microscopique d'un muscle squelettique révèle la présence de centaines ou de milliers de cellules très longues et cylindriques appelées fibres musculairesDisposées en rangs parallèles, mesurent de 10 à 100 μm de diamètre.
Malgré un diamètre habituel de 100 μm, certaines fibres peuvent atteindre jusqu'à 30 cm de long.
5.5.1. Les myofibrilles
Ce sont les éléments contractiles du muscle squelettique,Diamètre de 1 à 2 μm et contiennent trois types de structures encore plus petites appelées filaments (myofilaments).
Le diamètre respectif des filaments fins ou épais se rapproche de 8 et de 16 μm
Les filaments situés dans une myofibrille ne s'étendent pas sur toute la longueur de la fibre musculaire ; ils sont disposés en compartiments appelés sarcomères.
Des zones étroites et denses, en forme de plaques et appelées disques Z, séparent les sarcomères les uns des autres.
Dans un sarcomère, la région la plus sombre appelée bande A (anisotrope) s'étend d'une extrémité à l'autre des filaments épais et comprend des parties de filaments fins qui chevauchent les filaments épais.
Une région plus claire et moins dense appelée la bande I (isotrope) contient le reste des filaments fins, mais aucun filament épais.
Le disque Z passe à travers le centre de chaque bande I.
L'alternance des bandes A, sombres, et I, claires, donne à la fibre musculaire son apparence striée.
Une zone H, étroite, au centre de chaque bande A, ne contient que des filaments épais.
La strie M, qui divise la zone H, est formée de molécules de protéines qui relient les filaments épais adjacents.
Les deux protéines contractiles du muscle sont la myosine et l'actine.
Un filament épais comprend près de 200 molécules de myosine.
Chacune de celles-ci ressemble à deux bâtons de golf entrecroisés ; les queues (les poignées du bâton de golf) pointent vers la strie M au centre du sarcomère, alors que les têtes appelées ponts d'union s'étendent vers les filaments fins.
Les filaments fins s'étendent depuis des points d'ancrage dans les disques Z.
Ils se composent principalement d'actine.
Ils contiennent en outre des quantités moins importantes de deux protéines régulatrices, la tropomyosine et la troponine.
Sur chaque molécule d'actine se trouve un site de liaison de la myosine sur lequel peut se fixer un pont d'union.
Quand le muscle est au repos, la tropomyosine couvre les sites et empêche ainsi les ponts d'union de la myosine de se fixer à l'actine.
5.5.2. Le réticulum sarcoplasmique et les tubes transverses
Un système de citernes rempli de liquide et appelé réticulum sarcoplasmique (RS) entoure chaque myofibrilleDans une fibre musculaire au repos le RS stocke des Ca2+.
La libération de ces ions, qui passent du RS qui entoure les filaments fins et épais, déclenche la contraction musculaire.
Les ions calcium traversent des pores spéciaux situés dans le RS et appelés canaux de libération de Ca2+.
Les tubules transverses (tubules T) sont des replis internes en forme de tunnel du sarcolemme.
Ils pénètrent la fibre musculaire perpendiculairement au réticulum sarcoplasmique et aux filaments.
Ils s'ouvrent à l'extérieur de la fibre et sont remplis de liquide extracellulaire.
Des deux côtés d'un tubule transverse se trouvent des sacs terminaux dilatés du réticulum sarcoplasmique appelés citernes terminales.
Une triade est formée d'un tubule transverse et des citernes terminales de part et d'autre de celui-ci.
6.LA CONTRACTION DU MUSCLE
Hanson et Huxley avançaient que le muscle squelettique rétrécit pendant la contraction du fait que lesfilaments épais et fins glissent l'un près de l'autre.Leur modèle est appelé mécanisme de contraction par glissement des filaments.
6.1. Le mécanisme de contraction par glissement des filaments
Durant la contraction musculaire, les ponts d'union de la myosine tirent sur les filaments fins et les forcent à glisser à l'intérieur vers la zone HÀ mesure que les ponts tirent (appliquent une force) les filaments fins, ces derniers se rencontrent au centre du sarcomère.
Les ponts peuvent même tirer les filaments fins de chaque sarcomère tellement vers l'intérieur que leurs extrémités chevauchent
Pendant que les filaments fins glissent vers l'intérieur, les disques Z se rapprochent les uns des autres, et le sarcomère raccourcit, alors que la longueur des filaments épais et fins ne varie pas.
Le glissement des filaments et le raccourcissement des sarcomères entraînent le rétrécissement de la fibre musculaire et, ultimement, de tout le muscle.
6.2. Le rôle du calcium et des protéines régulatrices
Qu'est-ce qui déclenche et arrête le glissement des filaments ?Une augmentation de la concentration de Ca2+ dans le sarcoplasme amorce le glissement des filaments, alors qu'une diminution met fin au processus de glissement.
Quand une fibre musculaire est au repos (aucune contraction), la concentration de Ca2+ dans le sarcoplasme est faible, car la membrane du réticulum sarcoplasmique (RS) contient des pompes de transport actif de Ca2+ qui retirent le Ca2+ du sarcoplasme. le Ca2+ est stocké ou séquestré dans le RS.
Toutefois, à mesure qu'un potentiel d'action musculaire se déplace le long du sarcolemme et dans le système de tubules transverses, les canaux de libération de Ca2+ s'ouvrent dans la membrane du RS.
Il en résulte un flot de Ca2+ qui se déverse depuis l'intérieur du RS jusque dans le sarcoplasme situé autour des filaments épais et fins.
Les ions calcium libérés du RS se combinent avec la troponine dont ils modifient la forme.
Cette modification fait glisser le complexe troponine-tropomyosine hors des sites de liaison de la myosine sur l'actine.
6.3. La force motrice et le rôle de l'ATP
Il en résulte un flot de Ca2+ qui se déverse depuis l'intérieur du RS jusque dans le sarcoplasme situé autour des filaments épais et fins.Les ions calcium libérés du RS se combinent avec la troponine dont ils modifient la forme.
Cette modification fait glisser le complexe troponine-tropomyosine hors des sites de liaison de la myosine sur l'actine.
7.LE TISSU MUSCULAIRE CARDIAQUE
Le tissu musculaire cardiaque compose principalement la paroi du coeur.Bien qu'il soit strié comme un muscle squelettique, il est involontaire comme un muscle lisse.
De plus, certaines fibres musculaires cardiaques (et musculaires lisses) sont dotées d'autorythmicité, cequi leur permet d'établir un rythme inhérent de contraction et de relâchement en alternance.
7.1. L’anatomie
Les fibres du tissu musculaire cardiaque ont grossièrement la forme d'un quadrilatère de près de 14 μm de large.Elles ne possèdent habituellement qu'un seul noyau central
Le sarcolemme des fibres musculaires cardiaques ressemble à celui des fibres musculaires squelettiques, mais le sarcoplasme est plus abondant, et les mitochondries sont plus grosses et plus nombreuses.
La disposition de l'actine et de la myosine, les zones et les disques Z des fibres musculaires cardiaques sont identiques à celle des fibres squelettiques.
Les tubules transverses des fibres cardiaques sont plus volumineux que ceux des fibres squelettiques, et le RS est plus rare.
Dans un même réseau, chaque fibre est reliée aux fibres suivantes par des épaississements transverses irréguliers du sarcolemme appelés disques intercalaires.
Ces disques contiennent des desmosomes qui maintiennent les fibres ensemble et des jonctions lacunaires qui permettent aux potentiels d'action musculaires de passer d'une fibre musculaire à une autre
7.2. La physiologie
Dans les fibres musculaires cardiaques, les mitochondries sont plus volumineuses et plus nombreuses que dans les fibres musculaires squelettiques.Cette observation faite au microscope montre que le muscle cardiaque dépend largement du système aérobie pour produire l'ATP.
Par ailleurs, le système glycogène-acide lactique permet au muscle cardiaque de produire un peu d'ATP par la voie anaérobie.
En outre, les fibres musculaires cardiaques peuvent utiliser l'acide lactique produit par les fibres musculaires squelettiques afin de produire de l'ATP, ce qui constitue un avantage pendant les exercices.
Le tissu musculaire squelettique se contracte seulement sous la stimulation de l'acétylcholine libérée par un potentiel d'action d'un neurone moteur.
Le tissu musculaire cardiaque peut, en revanche, se contracter sans stimulation nerveuse extrinsèque (externe) ou hormonale; sa source de stimulation est le tissu nodal.
Une stimulation nerveuse peut seulement entraîner les fibres conductrices de ce réseau à augmenter ou à diminuer leur taux de décharge.
Une autre différence entre les tissus musculaires cardiaque et squelettique est que le premier reste contracté de 10 à 15 fois plus longtemps que le second, en raison d'une libération prolongée de Ca2+ dans le sarcoplasme.
Dans les fibres musculaires cardiaques, les Ca2+ entrent dans le sarcoplasme en provenance à la fois du réticulum sarcoplasmique (comme dans les fibres musculaires squelettiques) et du liquide extracellulaire.
8.LE TISSU MUSCULAIRE LISSE
8.1. L’anatomie
Le tissu musculaire lisse, comme le tissu musculaire cardiaque, est généralement involontaire.Un examen microscopique classique ne révèle pas la présence de myofibrilles.
Les fibres musculaires lisses sont beaucoup plus petites que les fibres musculaires squelettiques. Une fibre musculaire lisse mesure de 30 à 200 μm de long, est davantage épaisse en son milieu (3 à 8 μm) et est effilée à ses deux extrémités.
Chacune contient un seul noyau central ovale
Leur sarcoplasme renferme des filaments épais et fins non disposés en sarcomères ordonnés, contrairement aux fibres musculaires striées.
Dans les fibres musculaires lisses, il existe de 10 à 15 filaments fins par filament épais, alors que dans les fibres musculaires squelettiques, le rapport est de 2 à 1.
Il existe deux types de tissu musculaire lisse : viscéral et multi-unitaire.
Le type le plus courant est le tissu musculaire lisse viscéral (mono-unitaire).
Il forme des couches enveloppantes qui constituent une partie des parois des artérioles, des veines et des viscères creux tels que l'estomac, l'intestin, l'utérus et la vessie.
Les fibres du tissu musculaire viscéral forment d'importants réseaux du fait qu'elles contiennent des jonctions lacunaires.
Ces dernières permettent aux potentiels d'action musculaires de s'étendre dans tout le réseau.
Quand un neurotransmetteur, une hormone ou un signal autorythmique stimule une fibre, le potentiel d'action musculaire s'étend aux fibres voisines qui se contractent alors en bloc.
Le tissu musculaire lisse multi-unitaire est formé de fibres distinctes dotées chacune de ses propres terminaisons neuronales motrices et de quelques jonctions lacunaires entre les fibres voisines.
Alors que la stimulation d'une seule fibre musculaire viscérale provoque la contraction de plusieurs fibres adjacentes, la stimulation d'une fibre multi-unitaire provoque la contraction de cette seule fibre.
Le tissu musculaire lisse multi-unitaire se trouve dans les parois des grosses artères, dans les bronchioles, dans les muscles arrecteurs des poils qui se fixent aux follicules pileux, de même que dans les muscles radiaux et circulaires de l'iris qui ajustent le diamètre de la pupille.
8.2. La physiologie
Les processus de contraction sont sensiblement les mêmes dans les tissus musculaires lisse et strié. Toutefois, le tissu musculaire lisse possède plusieurs différences physiologiques importantes : sa contraction commence plus lentement et dure plus longtemps.De plus, le muscle lisse raccourcit et s'allonge davantage.
8.2.1. Le rôle de la calmoduline et de la kinase de la chaîne légère de la myosine
Une plus grande concentration de Ca2+ dans le sarcoplasme du muscle lisse provoque la contraction, tout comme dans un muscle strié. Le réticulum sarcoplasmique (le réservoir de Ca2+ dans les muscles striés) est rare dans le muscle lisse.Les ions calcium passent dans le sarcoplasme du muscle lisse depuis à la fois le liquide extracellulaire et le réticulum sarcoplasmique.
Vu l'absence de tubules transverses dans les fibres musculaires lisses, les Ca2+ sont plus lents à atteindre les filaments situés au centre de la fibre et à déclencher le processus contractile, ce qui explique partiellement la lente activation et la contraction prolongée du muscle lisse.
Dans le muscle lisse, la protéine régulatrice qui fixe les Ca2+ dans le cytosol est la calmoduline. (Ne pas oublier que la troponine tient ce rôle dans les fibres musculaires striées.)
Après s'être unie à Ca2+, la calmoduline active une enzyme appelée kinase de la chaîne légère de la myosine.
8.2.2. Le tonus du muscle lisse
Non seulement les Ca2+ pénètrent lentement dans les fibres musculaires lisses, mais ils sortent aussi lentement de la fibre musculaire quand la stimulation diminue.Cela retarde le relâchement, et le séjour prolongé des Ca2+ dans les fibres assure le tonus du muscle lisse, un état de contraction partielle permanente.
Le tissu musculaire lisse peut soutenir un tonus de longue durée, ce qui est important dans le tube digestif où les parois du tube maintiennent une pression constante sur le contenu du tube.
Cette caractéristique est aussi importante dans les parois des vaisseaux sanguins appelés artérioles, qui maintiennent une pression constante sur le sang.
8.2.3. La régulation de la contraction du muscle lisse
La plupart des fibres musculaires lisses se contractent ou se relâchent en réaction aux potentiels d'action qui proviennent du système nerveux autonome (involontaire).2- Les
Curares :
a) Dépolarisants :
- Succinylcholine (Celocurine®).
- Succinylcholine (Celocurine®).
b) Non-Dépolarisants :
- Bromure de pancuronium (Pavulon®) ;
- Rocuronium bromure (Esmeron®) ;
- Vécuronium bromure (Norcuron®) ;
- Chlorure de mivacurium (Mivacron®) ;
- Bésilate d’atracurium (Tracrium®
1 %).
3- Antagonistes :
- Bromure de pancuronium (Pavulon®) ;
- Rocuronium bromure (Esmeron®) ;
- Vécuronium bromure (Norcuron®) ;
- Chlorure de mivacurium (Mivacron®) ;
- Bésilate d’atracurium (Tracrium® 1 %).
a) La néostigmine (Prostigmine®) ;
b) Sugammadex (Bridion®).
Claude Meistelman: Professeur des Universités, praticien hospitalier Chef du service d'anesthésie-réanimation chirurgicale des hôpitaux de Brabois, centre hospitalier universitaire de Nancy.
Introduction
Plus de quatre siècles se sont écoulés entre la découverte par Sir Walter Raleigh d'un poison dans lequel les Indiens d'Amérique du Sud trempaient leur flèche et l'utilisation, par Griffith et Johnson en 1942, d'intocostrin ou d-tubocurarine pour provoquer un relâchement musculaire lors d'une anesthésie générale.Dès 1943, Wintersteiner et Dutcher réussissaient à extraire des quantités suffisantes de d-tubocurarine à partir de chondodendron tomentosum pour débuter la commercialisation, ce qui a permis l'essor de l'anesthésie balancée.
Depuis la d-tubocurarine, de nombreux curares sont apparus mais la majorité des molécules actuellement disponibles chez l'homme est obtenue par synthèse.
La marge de sécurité des curares au cours de ces 50 dernières années s'est trouvée améliorée grâce à la synthèse de molécules présentant peu ou pas d'effets secondaires.
L'emploi des curares reste limité à l'anesthésie-réanimation, la présence d'un matériel d'intubation et d'assistance ventilatoire étant indispensable avant toute administration.
Propriétés générales des Curares non dépolarisants
Mode d'action
Les curares agissent essentiellement en se fixant sur les récepteurs cholinergiques nicotiniques de la jonction neuromusculaire.Récepteur cholinergique
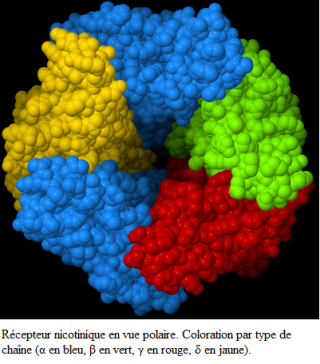
Le récepteur nicotinique postsynaptique est constitué de cinq sous-unités protéiques arrangées en forme de rosette dont le centre devient perméable sous l'effet de l'agoniste approprié.Deux sous-unités α sont identiques mais séparées par une unité β , les deux autres sous-unités sont appelées δ et ε.
Les récepteurs foetaux et extrajonctionnels possèdent une unité γ au lieu d'une unité ε .
Chacune de ces sous-unités est une protéine dont les deux terminaisons se trouvent du côté extracellulaire de la membrane.
Lorsque le récepteur est au repos, les domaines membranaires des cinq sous-unités se touchent de sorte que le récepteur ou canal est bouché.
La partie extracellulaire a la forme d'un entonnoir et constitue à peu près la moitié du récepteur.
Lorsque le récepteur est ouvert, la partie la plus étroite de l'entonnoir mesure 0,65 nm ce qui permet juste le passage des ions positifs comme le Na+ et le K+.
Le poids moléculaire du récepteur est d'environ 250 kDa.
La densité des récepteurs cholinergiques au niveau de la plaque motrice est d'environ 10 000/μm2 au niveau des crêtes des replis.
En revanche, la densité des récepteurs extrajonctionnels est faible (20μ/m2).
La molécule d'acétylcholine a une affinité particulière pour les sous-unités α .
Le récepteur ne devient activé que s'il y a deux molécules d'acétylcholine liées simultanément à chacune de ces deux sous-unités.
Il en résulte un changement de conformation des protéines du récepteur qui va provoquer l'ouverture du centre de la rosette et le passage des ions.
Le délai d'ouverture d'un canal est d'environ 10 μs pour une durée d'ouverture de 1 ms.
Les ions Na+ sont en quantité beaucoup plus importante à l'extérieur, ils sont attirés vers l'intérieur de la cellule en raison d'une part du potentiel intracellulaire négatif, et d'autre part du gradient de concentration favorable.
La sortie des ions K+ est freinée par le potentiel électrique négatif.
L'entrée d'ions positifs entraîne une dépolarisation dont l'amplitude dépendra du nombre de récepteurs activés et donc du nombre de vésicules d'acétylcholine libérées lors de la stimulation nerveuse.
Un quantum d'acétylcholine (10 000 molécules environ) active environ 1 700 récepteurs.
Sachant qu'il faut deux molécules d'acétylcholine par récepteur, 3 400 molécules environ vont être utilisées pour produire une dépolarisation de 0,5 à 1 mV, les autres molécules d'acétylcholine étant hydrolysées par l'acétylcholinestérase ou diffusant à l'extérieur de la fente synaptique.
Lors de l'arrivée d'un potentiel d'action dans la terminaison nerveuse, 200 quanta d'acétylcholine en moyenne sont libérés ce qui permet d'activer environ 340 000 récepteurs de la plaque motrice, ce qui est plus que suffisant pour produire un changement de potentiel au niveau de la plaque motrice appelé " potentiel de plaque ".
Ce potentiel a une amplitude d'au moins 40 à 50 mV au-dessus du potentiel de repos.
C'est ce potentiel de plaque qui donnera naissance à un potentiel d'action de la fibre musculaire.
En plus des phénomènes de libération par quanta, l'acétylcholine extravésiculaire pourrait atteindre la plaque motrice par un processus de fuite.
Canaux ioniques
Le potentiel de plaque va s'étendre à la zone périjonctionnelle qui se caractérise par un grand nombre de canaux sodiques qui peuvent être activés par un changement de potentiel électrique mais sont insensibles à l'acétylcholine.Contrairement au récepteur cholinergique, ils sont orientés vers l'intérieur de la cellule et ne laissent passer que les ions Na+.
Le canal sodique en position de repos est fermé.
La dépolarisation les active ce qui attire encore plus de Na+ vers l'intérieur de la cellule et provoque l'activation de plus de canaux.
L'activation de ces canaux produit un potentiel d'action qui va se propager de proche en proche par activation d'autres canaux sodiques sur toute la longueur de la fibre musculaire.
Le processus se termine par une inactivation des canaux sodiques 1 à 2 ms après leur activation et l'ouverture des canaux potassiques permettant une sortie rapide d'ions K+ et la repolarisation membranaire.
Le potentiel d'action se propage vers les deux extrémités de la fibre musculaire, il provoque une ouverture des canaux calciques qui laissent entrer le calcium dans la fibre musculaire.
Les canaux calciques sont situés sur la membrane cellulaire, sur les culs-de-sac de cette membrane ainsi que sur la membrane du réticulum endoplasmique.
L'ouverture des canaux calciques provoque une arrivée soudaine de Ca++ intracellulaire qui inhibe l'action d'une protéine intracellulaire, la troponine, dont le rôle est d'empêcher l'interaction entre les filaments d'actine et de myosine.
Les deux protéines vont alors pouvoir former des ponts entre elles, ce qui aura pour effet de raccourcir les filaments, de les solidifier et d'entraîner la contraction musculaire.
Effets présynaptiques des curares non dépolarisants
Il existe des récepteurs nicotiniques cholinergiques au niveau des terminaisons nerveuses présynaptiques.Le rôle de ces récepteurs serait de permettre un rétrocontrôle positif et la mobilisation des vésicules d'acétylcholine présynaptiques pour que sa libération soit maintenue lors des stimulations à haute fréquence.
L'acétylcholine augmenterait sa propre mobilisation par une activation des canaux calciques avec entrée de calcium qui se combinerait avec la calmoduline pour entraîner une inhibition de la synapsine I et un mouvement des vésicules vers les zones actives.
Plusieurs faits sont en faveur du rôle de ces récepteurs.
L'application d'acétylcholine directement au niveau de la plaque motrice n'entraîne pas de diminution de potentiel de plaque lorsque la fréquence est élevée.
De même, la quantité d'acétylcholine diminue peu lors d'une stimulation à haute fréquence alors que la présence d'un curare non dépolarisant accentue cette baisse.
Ces faits indiqueraient que l'épuisement en présence de faibles doses de curare non dépolarisant n'est pas un phénomène postsynaptique mais est lié au blocage de ces récepteurs présynaptiques.
Effets sur le système nerveux autonome
Ces effets sont tous dose dépendants, additifs. Leur intensité n'est pas diminuée par le ralentissement de la vitesse d'injection.Effet ganglioplégique
Cet effet est lié au blocage des récepteurs nicotiniques postsynaptiques situés au niveau ganglionnaire.L'effet ganglioplégique a été observé essentiellement avec la d-tubocurarine, où il survient à des doses proches des doses curarisantes.
Il est quasiment inexistant avec les curares stéroïdiens, l'atracurium ou le mivacurium, car il faut des doses au moins 50 fois supérieures aux doses curarisantes.
Effets sur les récepteurs muscariniques
L'inhibition des récepteurs muscariniques M2 situés au niveau du noeud sinusal peut être responsable d'une tachycardie.Les éventuelles propriétés vagolytiques d'un curare sont appréciées par le rapport DA50 vagolytique/DA50 curarisante.
Le rapport DA50 vagolytique/DA50 curarisante est aux environs de 4 pour le pancuronium alors qu'il est de 25 pour l'atracurium et 80 pour le vécuronium.
De tous les curares non dépolarisants, la gallamine est le plus vagolytique, le rapport étant égal à 0,6.
Il existe également des récepteurs présynaptiques muscariniques de type M2 au niveau des terminaisons noradrénergiques. Ces récepteurs auraient pour rôle de diminuer la libération de noradrénaline.
En bloquant ces récepteurs, le pancuronium et la gallamine augmenteraient la libération de noradrénaline ce qui majorerait la tachycardie liée à leurs propriétés vagolytiques.
D'autres récepteurs muscariniques de type M2 sont présents au niveau des interneurones dopaminergiques de type SIF (small intensely fluorescent). Ces neurones sont activés par l'acétylcholine libérée par les collatérales des fibres cholinergiques préganglionnaires.
La dopamine libérée par ces neurones entraîne une hyperpolarisation des neurones postganglionnaires adrénergiques, ce qui entraîne une inhibition de la transmission ganglionnaire.
Le bloc de ces récepteurs muscariniques induit par la gallamine et le pancuronium entraîne une facilitation de la transmission ganglionnaire et de l'activité sympathique.
Effets sur la libération et le recaptage de la noradrénaline
Le pancuronium et le fazadinium bloquent le recaptage neuronal de la noradrénaline (type 1) au niveau du muscle cardiaque et des fibres lisses. Bien que cet effet apparaisse pour de fortes doses, c'est ce mécanisme qui expliquerait l'éventuelle augmentation de concentration plasmatique des catécholamines observée chez certains patients, tels ceux porteurs d'un phéochromocytome.Cet effet serait aussi à l'origine des interactions observées avec d'autres médicaments capables de bloquer le recaptage des catécholamines, tels les imipraminiques.
Des tachycardies, voire l'apparition de troubles du rythme, ont été décrits chez des patients traités de façon chronique par de l'imipramine et ayant été anesthésiés avec une association halothane-pancuronium.
L'atracurium peut inhiber le recaptage de type 1 et de type 2 (extraneuronal) mais à des concentrations très supérieures à celles entraînant un bloc neuromusculaire.
Libération d'histamine
Histaminolibération non spécifique
De nombreux composés basiques chargés positivement peuvent entraîner une histaminolibération.Le mécanisme est lié à la fixation et à l'action directe du curare à la surface des mastocytes et des basophiles ce qui va entraîner une libération d'histamine, le calcium étant impliqué dans ce mécanisme.
L'histaminolibération non spécifique est une exagération de l'effet pharmacologique.
Elle n'est pas médiée par des anticorps et survient sans exposition antérieure au produit. Elle est favorisée par la vitesse d'injection du curare, la dose ainsi que l'existence d'un terrain atopique.
La traduction clinique d'une histaminolibération non spécifique est habituellement moins sévère que lors d'une réaction immunologique car la libération d'histamine est moins massive.
La d-tubocurarine est fortement histaminolibératrice, celle-ci survenant pour des doses proches des doses curarisantes. Une dose de 500 à 600 g/kg en 30 secondes multiplie par 4 à 6 les concentrations d'histamine plasmatique.
Les autres benzylisoquinolines (atracurium, mivacurium) entraînent une histaminolibération pour des doses égales à trois fois la DA95.
Le cisatracurium est le premier curare de ce groupe quasiment dénué d'effets histaminolibérateurs aux posologies usuelles.
Les curares stéroïdiens n'entraînent pas d'histaminolibération.
Les curares semblent induire une histaminolibération préférentiellement à partir des mastocytes cutanés plutôt qu'à partir des mastocytes pulmonaires comme ce peut être le cas avec le propofol.
Elle peut se traduire cliniquement par une éruption cutanée transitoire au niveau du visage et du cou, une tachycardie, voire une baisse transitoire de la pression artérielle pendant les 5 minutes suivant l'injection.
Anaphylaxie
Les accidents allergiques peuvent survenir avec n'importe quel curare.Il s'agit de réactions d'hypersensibilité immédiate (type I) liées à la production d'IgE (immunoglobulines E) spécifiques qui se fixent sur les récepteurs spécifiques membranaires des mastocytes tissulaires et des basophiles circulants ainsi que sur des récepteurs spécifiques situés sur les plaquettes et les éosinophiles.
La partie allergénique des curares est l'ammonium quaternaire.
Les patients peuvent avoir été sensibilisés par une exposition antérieure à un curare ou à des substances porteuses d'ions ammonium quaternaires (agents cosmétiques, désinfectants, etc).
Ces mécanismes de sensibilisation expliquent la grande fréquence des réactivités croisées entre curares (70 %) ainsi que la possibilité d'accidents chez des patients n'ayant jamais été anesthésiés.
L'administration de l'allergène entraîne sa réaction avec les IgE et l'accident anaphylactique par activation membranaire des basophiles et des mastocytes aboutissant à la libération massive de médiateurs préformés (histamine, tryptase, sérotonine) et reformés (prostaglandines, leucotriènes, facteur d'agrégation plaquettaire).
En cas d'accident anaphylactique, les signes cliniques sont habituellement au complet et sont souvent plus graves qu'en cas d'accidents anaphylactoïdes.
Les curares n'entraînent pas d'activation de la voie du complément.
Activité anticholinestérasique
En raison de leur parenté structurale avec l'acétylcholine, les curares peuvent se fixer sur les sites actifs des cholinestérases et entraîner une éventuelle inhibition de leur activité.L'inhibition de l'acétylcholinestérase d'origine globulaire survient pour des concentrations très supérieures à celles responsables du bloc neuromusculaire et n'a aucune traduction clinique.
De même, l'inhibition de la butyrylcholinestérase plasmatique ne survient que pour des doses très élevées, exception faite du pancuronium.
L'inhibition de la butyrylcholinestérase par le pancuronium survient pour des concentrations 1 000 fois inférieures à celles observées avec les autres curares non dépolarisants.
Le rapport des concentrations inhibant l'activité des cholinestérases de 50 % (I50AChE/I50BuChE) est proche de 5 000 pour le pancuronium alors qu'il est compris entre 2 et 12 pour la majorité des autres curares non dépolarisants.
L'inhibition de la butyrylcholinestérase par le pancuronium explique la longue durée d'action d'une faible dose de mivacurium (10 g/kg) injectée en fin d'intervention, chez un patient préalablement curarisé par du pancuronium.
Relation structure-activité
Les curares non dépolarisants sont tous porteurs d'au moins un groupe ammonium quaternaire, le plus souvent deux, qui permettent la fixation au niveau des mêmes sites que l'acétylcholine sur le récepteur cholinergique.Les deux ammoniums sont séparés par une structure lipophile de taille variable. Pendant longtemps, on a considéré que la distance entre les deux atomes d'azote devait être comprise entre 12 et 14 A.
Cette notion a moins d'importance avec les curares non dépolarisants qu'avec les curares dépolarisants, la distance étant de 10 à 11 A pour certains curares stéroïdiens. À l'opposé, certains dérivés des benzylisoquinolines ont une distance de 18 à 21 A entre les deux ammoniums.
De même, l'existence de deux ammoniums quaternaires n'est pas indispensable, le second atome d'azote pouvant être sous forme tertiaire et non quaternaire aux pH physiologiques (d-tubocurarine, vécuronium).
La gallamine est le seul curare porteur de trois ammoniums quaternaires.
Les curares non dépolarisants sont tous des molécules hydrosolubles diffusant mal en dehors du secteur hydrique extracellulaire en raison de leur ionisation aux pH physiologiques. Le passage de la barrière hématoencéphalique ou foetoplacentaire est donc faible.
Deux grandes familles de curares non dépolarisants existent : les dérivés stéroïdiens et les benzylisoquinolines.
La classe des curares stéroïdiens comprend le pancuronium, le pipécuronium, le vécuronium, le rocuronium et l'Org 9487.
Ces agents ont en commun leur absence d'effets histaminolibérateurs.
Certains peuvent avoir des propriétés vagolytiques (pancuronium).
Ils sont tous éliminés par le rein, de plus le vécuronium et le rocuronium sont métabolisés dans le foie.
Les benzylisoquinolines ont toutes une parenté structurale avec la d-tubocurarine. Il s'agit de la métocurine, de l'atracurium, du doxacurium, du mivacurium et du cisatracurium.
Ces agents sont dépourvus d'effet vagolytique mais sont responsable d'une histaminolibération pharmacologique parfois aux doses thérapeutiques.
Leur mode d'élimination varie selon les molécules, même s'ils sont tous excrétés par le rein.
Le mivacurium est dégradé par les pseudocholinestérases plasmatiques, l'atracurium et le cisatracurium sont dégradés par la voie de Hofmann.
Influence des paramètres pharmacocinétiques/pharmacodynamiques
- La vitesse d'installation de la curarisation est largement dépendante des facteurs circulatoires et de la puissance de la molécule alors que la durée d'action dépend essentiellement de la vitesse d'élimination.
Vitesse d'installation de la curarisation
Le délai d'installation du bloc neuromusculaire correspond par définition au temps compris entre la fin de l'administration et l'obtention du bloc maximal.Paramètres hémodynamiques
Il existe une relation directe entre le débit cardiaque et le délai d'installation de la paralysie.Cette relation explique pourquoi les curares ont un délai d'action plus bref chez le nourrisson et l'enfant que chez l'adulte et que les sujets âgés ont un délai d'action allongé par rapport à des patients plus jeunes.
L'agent anesthésique d'induction intervient également. Gill et Scott ont démontré que la paralysie induite par le vécuronium s'installait plus rapidement après induction par l'étomidate qu'avec le propofol ou le thiopental.
Il existe une corrélation entre la baisse tensionnelle et le délai d'installation du bloc neuromusculaire.
Le débit sanguin musculaire peut également intervenir.
L'activité métabolique du muscle peut aussi jouer un rôle.
Chez l'homme, l'installation du bloc neuromusculaire est plus rapide au niveau du diaphragme et des muscles adducteurs laryngés qu'au niveau du pouce malgré leur résistance aux curares non dépolarisants.
Après administration d'une dose de 40 g/kg de vécuronium, le délai d'installation de la paralysie est de 3,3 au niveau des muscles laryngés et de 5,7 minutes au niveau de l'adducteur du pouce.
Ces résultats, apparemment contradictoires, s'expliquent par le fait que les muscles respiratoires sont mieux vascularisés que les muscles périphériques et reçoivent une quantité importante de molécules, ce qui entraîne l'installation plus rapide de la paralysie malgré leur résistance.
Constante de transfert (ke0)
L'installation du bloc neuromusculaire est retardée dans le temps par rapport à l'évolution des concentrations artérielles plasmatiques de curare qui atteignent un pic 25 à 35 secondes après l'injection alors que la curarisation n'est pas encore détectable.Ce phénomène souligne le rôle joué par les concentrations au niveau de la jonction neuromusculaire par rapport aux concentrations plasmatiques.
Pour tenter de répondre à ce problème, Hull et Sheiner ont fait l'hypothèse que le site d'action pourrait être représenté par un compartiment théorique appelé " compartiment effet " en liaison avec le compartiment central et dans lequel la concentration de curare serait directement liée à l'effet, c'est-à-dire au bloc neuromusculaire.
Ce type de modèle permet de déterminer la vitesse d'équilibration entre le plasma et la jonction neuromusculaire et de définir une constante de transfert ou ke0.
Ce paramètre permet de calculer la demi-vie d'installation de l'effet ou T1/2ke0.
La valeur de la ke0 est une grandeur théorique mais elle permet d'avoir une approche de la vitesse d'installation de la curarisation.
Elle dépend essentiellement des paramètres circulatoires et du coefficient de partition du curare entre le sang et les muscles striés.
Une valeur comparable (5 à 7 min pour la T1/2ke0) a été retrouvée pour la majorité des curares non dépolarisants à l'adducteur du pouce.
C'est le doxacurium qui a la demi-vie d'installation de l'effet la plus longue (14-20 min)ce qui correspond au fait que c'est le curare non dépolarisant dont le délai d'action est le plus long de tous les agents utilisés chez l'homme.
À l'opposé, la demi-vie d'installation de l'effet du rocuronium est la plus courte (4 min) au niveau du pouce.
Elle est significativement plus brève au niveau des muscles adducteurs laryngés (2,7 min) ce qui confirmerait le rôle des facteurs circulatoires pour expliquer le délai d'installation plus bref au niveau des muscles respiratoires.
Accès au récepteur
Le temps de diffusion au sein de la fente synaptique n'influence probablement pas le délai d'action.Il a été démontré que les molécules de d-tubocurarine pouvaient pénétrer et quitter la fente synaptique en quelques millisecondes.
De même la vitesse de liaison aux récepteurs cholinergiques, dès que les molécules ont pénétré dans la fente synaptique, est très courte et sans retentissement sur l'installation de la paralysie.
Puissance
Il existe un nombre croissant d'arguments en faveur de la relation entre délai d'installation de la paralysie et puissance des curares.En cas de propriétés physicochimiques proches, les curares les moins puissants présentent le délai d'action le plus bref.
De tous les curares non dépolarisants, disponibles chez l'homme, le doxacurium, qui est le plus puissant (DA95 : 25 g/kg), est celui qui possède le délai d'installation de la paralysie le plus long (10 à 15 min).
À l'opposé, le rocuronium, qui est sept fois moins puissant que le vécuronium, présente à doses équipotentes un délai d'installation de la paralysie plus court que celui du vécuronium, que ce soit au niveau de l'adducteur du pouce (2,4 versus 5,7 min) ou des muscles adducteurs laryngés (1,4 versus 3,3 min).
L'Org 9487, qui est trente fois moins puissant que le vécuronium, est le premier curare non dépolarisant à présenter un délai d'action comparable à celui du suxaméthonium.
Ces observations s'expliquent par la théorie d'occupation des récepteurs et le concept de marge de sécurité de la jonction neuromusculaire.
Quelle que soit la puissance d'un curare, un nombre critique de récepteurs doit être occupé pour que s'installe le bloc neuromusculaire.
La paralysie de l'adducteur du pouce est complète quand environ 92 % des récepteurs sont occupés par les molécules de curare non dépolarisant.
Après l'arrivée dans la fente synaptique, quasiment toutes les molécules de curare se retrouvent liées aux récepteurs.
En l'absence de différences pharmacocinétiques, quand un curare puissant est utilisé, le nombre de molécules atteignant la jonction neuromusculaire est faible par rapport à un curare de moindre puissance en raison de concentrations plasmatiques plus basses.
Il en résultera que le temps nécessaire à la saturation des récepteurs sera plus long avec un curare puissant et que le délai d'installation de la paralysie sera important.
Dose
L'intensité du bloc neuromusculaire est dose dépendante mais cette relation n'est pas linéaire.Si de faibles doses sont administrées, il peut ne pas y avoir de bloc neuromusculaire, en revanche au-delà d'une certaine dose, toute augmentation de posologie n'entraînera qu'une discrète variation d'intensité du bloc.
En effet quand la paralysie devient proche de 100 %, il faut une augmentation relativement importante des concentrations pour entraîner une baisse de 1 % de la force musculaire.
Le délai d'installation de la paralysie est indépendant de la dose aux posologies donnant un bloc de moins de 100 % pour une molécule donnée.
En revanche, le délai d'action peut être raccourci en donnant de fortes doses de curare qui permettent d'obtenir plus rapidement un degré de saturation des récepteurs de la jonction neuromusculaire entraînant l'obtention d'un bloc complet.
Le délai d'action du vécuronium passe de 208 secondes après un bolus de 100 g/kg à 106 secondes après une dose de 400 g/kg (huit fois la DA95).
Aux fortes doses, le facteur limitant est probablement lié aux conditions circulatoires (débit cardiaque, débit sanguin musculaire).
L'utilisation éventuelle de fortes doses entraîne deux problèmes :
l'augmentation de la durée d'action
et l'apparition d'éventuels effets secondaires cardiovasculaires.
Seul le vécuronium a pu être utilisé à des posologies comprises entre six et huit fois la DA95 car il était jusqu'à maintenant le seul curare non dépolarisant totalement dénué d'effets secondaires cardiovasculaires, ce qui n'est plus le cas depuis l'apparition du cisatracurium.
Les autres curares ne peuvent être utilisés à de telles doses en raison du risque d'effets secondaires.
Ainsi l'atracurium ou le mivacurium ne peuvent être utilisés à des posologies supérieures à 600 et 200 g/kg respectivement, en raison de l'histaminolibération.
L'administration de doses de vécuronium de six à huit fois la DA95 pour raccourcir le délai d'action entraîne un allongement important de la durée d'action.
La durée d'action clinique à l'adducteur du pouce passe de 42 minutes après un bolus de 100 g/kg à 115 minutes avec des extrêmes compris ente 35 et 191 minutes lors de l'injection d'une dose de 400 g/kg.
Durée d'action
Les curares peuvent être classés en quatre groupes en fonction de leur durée d'action clinique à l'adducteur du pouce après administration d'une dose de deux fois la DA95.Cette durée d'action doit être inférieure à 8 minutes pour les curares ultracourts.
Elle est comprise entre 8 et 20 minutes pour les curares courts, entre 20 et 50 minutes pour les molécules de durée d'action intermédiaire.
Les curares de longue durée d'action ont une durée d'action clinique supérieure à 50 minutes.
Paramètres pharmacocinétiques
Contrairement au délai d'installation de la paralysie, la durée d'action est largement dépendante de la décroissance des concentrations plasmatiques.Cette dernière dépend à la fois des phénomènes de redistribution, de métabolisme et d'élimination.
L'effet d'un curare commence à diminuer quand les concentrations plasmatiques artérielles deviennent inférieures aux concentrations à la jonction neuromusculaire.
Pour les curares de longue durée d'action (d-tubocurarine, pancuronium), la décurarisation a lieu pendant la phase d'élimination, le pseudoéquilibre entre les concentrations plasmatiques et celles de la jonction neuromusculaire étant déjà obtenu.
Il existe dans ce cas une relation entre baisse des concentrations plasmatiques et demi-vie d'élimination.
L'augmentation des doses entraîne un allongement de la durée d'action car le temps nécessaire pour arriver à une concentration à partir de laquelle la décurarisation s'installe sera prolongé.
En revanche, l'index de récupération est relativement constant et en relation avec la constante d'élimination de la molécule considérée.
L'atracurium a une demi-vie d'élimination brève (20 min), la décurarisation va donc se produire pendant la phase prédominante d'élimination.
En revanche, le vécuronium ou le rocuronium se comportent différemment de l'atracurium. Bien qu'ils aient une demi-vie d'élimination comprise entre 1 et 2 heures, leur durée d'action et leur vitesse de décurarisation sont comparables à celles de l'atracurium.
Ces discordances apparentes, par rapport à l'atracurium, s'expliquent par l'importance des phénomènes de redistribution pour ces deux curares.
Les concentrations plasmatiques vont diminuer jusqu'à des concentrations compatibles avec la décurarisation pendant la phase de distribution, rendant moins importants que pour les autres curares les phénomènes d'élimination.
Ainsi, malgré des profils pharmacocinétiques différents, l'atracurium, le vécuronium et le rocuronium ont des durées d'action et des vitesses de décurarisation proches.
Paramètres pharmacodynamiques
Après administration d'un curare non dépolarisant, le diaphragme ou les muscles adducteurs laryngés se décurarisent plus rapidement que les muscles périphériques tels que l'adducteur du pouce.Ces résultats s'expliquent par la résistance des muscles respiratoires.
Plaud a pu démontrer qu'en cas de bloc lié au rocuronium, la concentration théorique dans le compartiment effet entraînant une diminution de 50 % de la force musculaire, était de 1424 g/L pour les muscles laryngés alors qu'elle n'atteignait que 823 g/L pour l'adducteur du pouce.
En cas de patient " sensible " aux effets des curares, la durée d'action sera prolongée par rapport à un autre patient car il faudra atteindre des concentrations plasmatiques plus basses avant que n'apparaissent les premiers signes de décurarisation.
Les différentes familles de curares :
Dépolarisants :
Célocurine = Succinylcholinenon dépolarisants :
- Stéroïdes :
- Pavulon = Pancuronium
- Norcuron = Vécuronium
- Esméron = Rocuronium
- Benzylisoquinones :
- Tracrium = Atracurium
- Mivacron = Mivacurium
- Nimbex = Cisatracurium
Les myorelaxants dépolarisants (CD)
Reproduisent l’effet de l’acétylcholine sur la plaque motrice et sont considérées comme des agonistesCes molécules agonistes peuvent se lier aux récepteurs postsynaptiques et provoquer la dépolarisation de la plaque motrice. Lorsque le potentiel transmembranaire est réduit de -90 à -57 mV, la transmission neuromusculaire est bloquée.
La durée de la liaison au récepteur
succinylcholine = l’acétylcholine (brève durée, QQ milliseconde).
- L’effet dépolarisant
- l’acétylcholine disparaît en quelques ms à cause de sa dégradation rapide par l’acétylcholinestérase
- la concentration de succinylcholine dans la fente synaptique persiste plus longtemps, dépendant de l’effet des pseudocholinestérases.
- La succinylcholine a donc un effet biphasique, provoquant une contraction initiale suivie d’une paralysie durant normalement une dizaine de minutes
Ces canaux ont deux « portes » qui contrôlent les mouvements du sodium. Le passage transmembranaire du sodium requiert l’ouverture simultanée de ces deux portes alors que la fermeture d’une seule abolit les mouvements ioniques.
Ces deux portes interviennent de manière séquentielle, donc le canal sodique passe par trois états .
Au repos, la porte inférieure (dépendante du temps ou porte d’inactivation) est en position ouverte, la porte supérieure, voltage dépendante, est fermée et aucun transfert sodique ne peut se faire.
Variation brutale de potentiel en raison de la dépolarisation de la plaque motrice adjacente, la porte voltage dépendante s’ouvre alors que la porte inférieure est ouverte et un courant sodique s’établit et entraîne la dépolarisation membranaire.
Très rapidement, la porte inférieure se ferme et le courant ionique s’interrompt. La partie voltage dépendante du canal sodique reste ouverte tant que persiste la dépolarisation de la plaque motrice adjacente.
Lorsque la dépolarisation de la plaque motrice prend fin, la partie voltage dépendante se referme et la partie inférieure, dépendante du temps s’ouvre, le canal sodique repasse en position de repos
Ce cycle est rapide lorsque la plaque motrice subit l’action de l’acétylcholine, mais la décroissance lente de la concentration de la succinylcholine dans la fente synaptique prolonge la dépolarisation de la plaque motrice.
Initialement, la dépolarisation de la plaque motrice par la succinylcholine provoque l’ouverture de la partie voltage dépendante du canal sodique et la dépolarisation de la membrane musculaire de proche en proche.
Très rapidement, la fermeture de la partie inactivante du canal sodique interrompt le transfert sodique et empêche la dépolarisation de la fibre musculaire.
Tant que la dépolarisation de la plaque motrice persiste, la partie voltage dépendante du canal sodique reste ouverte et la partie inférieure reste fermée, le canal sodé est dans un stade inactivé.
Les canaux sodiques des fibres musculaires sont donc protégés de la dépolarisation par l’inactivation des canaux sodiques adjacents à la plaque motrice pendant toute la durée de dépolarisation de cette dernière.
- La membrane musculaire est donc faite de trois zones :
- La plaque motrice dépolarisée par la succinylcholine,
- une couronne de canaux sodiques autour de la plaque motrice qui sont dans un état inactivé et
- le reste de la membrane musculaire dont les canaux sodiques sont au stade de repos.
N.B:
Dans les muscles extraoculaires, des fibres toniques ont une innervation multiple et restent capables de répondre à l’acétylcholine car leurs fibres conservent leur excitabilité sur toute leur surface. Ces fibres répondent à la succinylcholine par une contracture soutenue qui explique l’augmentation de PIOC observée après injection de ce curare.Les myorelaxants non dépolarisants (CND)
- Provoque un Bloc Non-Dépolarisant:
- Ce bloc est encore appelé bloc antagoniste ou compétitif.
- Ce bloc résulte de la compétition entre les molécules d’acétylcholine et de CND au niveau des récepteurs postsynaptiques de l’acétylcholine localisés sur les sous-unités α des récepteurs.
- Cette compétition obéit à la loi d’action de masse.
Définitions :
| Dose active 50 %(DA50) | Dose responsable d'une dépression de 50 % de la force musculaire |
| Dose active 95 %(DA95) | Dose responsable d'une dépression de 95 % de la force musculaire |
| Délai d'installation | Intervalle de temps entre la fin de l'injection d'un curare et l'apparition du bloc maximal |
| Durée d'actionclinique | Intervalle de temps entre la fin de l'injection et la récupération spontanée de 25 % de la force musculaire initiale |
| Durée d'action totale | Intervalle de temps entre la fin de l'injection et la récupération spontanée de 90 % de la force musculaire initiale |
| Index de récupération(TH 25-75) | Intervalle de temps entre la récupération de 25 % et 75 % de la force musculaire initiale |
| Courbe dose-action |
relation dose-effet (linéaire), courbe permettant de classer les CND en fonction de leur puissance |
Installation
Installation dépend :- Du débit sanguin musculaire : plus le débit est rapide, plus l'installation est courte.
- Chez l'enfant, débit sanguin plus rapide installation rapide
- L'Etomidate déprime moins le débit sanguin que le Propofol installation plus rapide avec Etomidate.
- Du débit cardiaque : plus le débit est rapide, plus l'installation est rapide.
- De la puissance du curare : plus le curare est puissant, moins l'installation est rapide.
- Quand un CND est peu puissant → administration d'une dose importante → gradient de concentration important → saturation rapide des récepteurs.
- Actuellement : recherche pour des CND peu puissant, donc à installation rapide.
- De la dose : plus on augmente dose CND, plus on diminue la durée d'installation.
- Problème : à doses très élevées ;effets secondaires +++, surtout avec benzylisoquinones.
Durée d'action clinique := délai entre injection et récupération de 25% de la force musculaire.
- Elle dépend :
- Du curare :
- courte durée d'action : Exemple : Mivacron (25 mn).
- durée d'action intermédiaire : Exemple : Norcuron, Tracrium, Esméron, Nimbex.
- longue durée d'action : Exemple : Pavulon.
- De la dose : Plus la dose est élevée, plus l'action est longue.
- Du curare :
Index de récupération : = délai entre 25 et 75% de récupération de la force musculaire = IR 25-75%
- Dépend :
- Du curare
- De la dose : curares à effet cumulatif, comme le Pancuronium et le Vécuronium (à chaque dose de réinjection, effet cumulatif la durée d'action de la dose est augmentée).
- Ne dépend pas de la dose pour les CND non cumulatifs comme le Mivacurium, l'Atracurium et le Rocuronium.
Durée d'action totale
- Dépend de :
- Du curare
- De la dose
Métabolisme et métabolites :
Différents types de métabolisme selon les curares :
1) Métabolisme hépatique :
Pancuronium (à 20 %), Rocuronium et Vécuronium sont métabolisés par le foie et éliminés par le rein. Les métabolites sont actifs.Problème chez les insuffisants rénaux...
2) Voie de Hofmann (ou dégradation d'Hofmann) et hydrolyse plasmatique (autre que pseudocholinestérase) :
Métabolisme par voie enzymatique (plasmatique), sans intervention du rein, ni du foie. Métabolites inactifs.- Exemple : Tracrium, Nimbex.
3) Métabolisme par enzymes pseudocholinestérase plasmatique :
- Elles sont fabriquées par le foie. Les métabolites sont inactives.
- Exemple : Mivacron.
- Allongement de la durée d'action si déficit en cholinestérase plasmatique (cirrhose, déficit congénital).
- Problème : variation de l'activité cholinestérasique selon les patients, d'où variation de durée d'action.
Pharmacodynamique comparée :
1) Pharmacocinétique des CND :
Tous les CND ont un volume de distribution à peu près identique. C'est la clairance qui détermine leur durée d'action.|
Curare d'action rapide |
Curares d'action intermédiaire |
Curare d'action lente |
|---|---|---|
|
Mivacurium |
Atracrium |
Pancuronium |
| Vécuronium | ||
|
Rocuronium |
2) Puissance comparée des CND :
Plus le CND est puissant, plus la dose est faible à effet identique.| CND |
DA95 (mg/kg) |
Dose d'intubation (mg/kg) |
|---|---|---|
| Atracurium | 0,25 |
0,50 - 0,60 |
| Mivacurium | 0,08 |
> 0,20 |
| Vécuronium | 0,05 |
0,10 - 0,15 |
| Rocuronium | 0,30 | 0,60 |
| Pancuronium | 0,06 | 0,07 |
| Cisatracurium |
|
0,15 |
3) Les différents curares :
|
Dose (mg/kg) |
Installation (sec) |
Durée clinique (min) TH 25 |
Durée totale (min)T4/T1 > 0,8 |
|
|---|---|---|---|---|
| Dépolarisant | ||||
| Succinylcholine | 1 |
60 |
8-10 | 12 |
|
Non Dépolarisant |
||||
| Mivacurium |
> 0,2 |
180 | 15 | 20-30 |
| Atracurium | 0,5 | 180-240 | 30-40 | 60-70 |
| Rocuronium |
0,6 |
90-120 | 30-40 | 60-70 |
|
Vécuronium |
0,1 | 180-240 | 30-40 | 60-70 |
| Pancuronium | 0,1 | 160-200 | 60-80 | > 120 |
Populations particulières
1. Insuffisance hépatique (cirrhose):
a) Pharmacocinétique :
Pancuronium, Vécuronium, Rocuronium sont métabolisé par le foie, Mivacurium est métabolisé par les pseudocholinestérase fabriquée par le foie problème quand insuffisance hépatique.L'Atracurium et le Cisatracurium sont métabolisés par voie d'Hofmann, donc pas de problème avec ces deux CND chez les insuffisants hépatiques.
b) Pharmacodynamique des CND :
- Ictère : augmentation durée d'action des CND excrétés par la bile (stéroïdes)
- + 60% pour le Pancuronium
- + 45% pour le Vécuronium
- 0 pour Atracurium
- Cirrhose : augmentation du métabolisme
- Atracurium : aucun effet
- Vécuronium : peu d'effet si 0,1 à 0,15 mg/kg , > 0,2 mg/kg : augmentation de 25% de la durée d'action
- Mivacurium : baisse activité enzymatique d'où augmentation durée d'action (+15-75%)
- Rocuronium : aucun effet
- Pancuronium : augmentation dose initiale (augmentation du volume de distribution),
- augmentation de la durée d'action.
Atracurium et Cisatracurium = CND des insuffisants hépatiques !
2) Insuffisance rénale (IR) :
a) Pharmacocinétique :
Les CND ont une élimination rénale. De plus, le Pancuronium et le Vécuronium ont des métabolites actives . Donc, si IR, augmentation de la profondeur du bloc.- Atracurium ++; Cisatracurium ++; Rocuronium; Mivacurium; sont les CND à utiliser.
b) Pharmacodynamie :
Augmentation de la durée d'action pour le Pancuronium.3) Pédiatrie
Facteurs de variation :
- structures musculaires, jonctions neuromusculaires, récepteurs de l'Ach : sont immatures de 0 à 3 mois, en cours de maturation de 3 mois à 2 ans, matures après 2 ans.
- volume liquide extracellulaire : volume de distribution plus important
- fonction rénale : moins bonne
- débit cardiaque : augmenté
Puissance des curares selon l'âge :
- La DA95 est augmentée chez l'enfant de 1 à 12 ans, étant plus résistant en raison de leur croissance.
Débit de perfusion des CND
- augmenté chez l'enfant.
Pharmacodynamique des curares :
- nouveau né : diminution installation
- diminution dose
- augmentation durée d'action
- nourrisson : augmentation de l'installation
- augmentation de la durée d'action
- enfant > 1 an : augmentation dose
- diminution durée d'action
- Augmentation du risque d'histaminolibération.
4) Personnes agées
Facteurs de variation :
- augmentation masse grasse
- diminution de l'eau totale (baisse volume de distribution)
- diminution de la concentration albumine
- diminution du nombre de récepteurs
- diminution de la filtration glomérulaire (rein)
- diminution du débit splanchnique (foie)
- diminution de l'activité enzymatique
- variation du débit cardiaque
Atracurium, Cisatracurium, Mivacurium : sont les CND de la personne âgée.
Effets secondaires :
1) Hémodynamique :
- Aucun effet sauf le Pancuronium qui augmente la fréquence cardiaque et parfois la TA.
2) Histaminolibération :
Histaminolibération non spécifique :
- Cette histaminolibération est à distinguer d’une authentique réaction allergique, pouvant survenir lors de la première administration du produit . Elle provient d’une stimulation directe des mastocytes et n’implique aucune IgE.Concerne l'Atracurium et le Mivacurium.
Signes :
- hypoTA modérée
- rash cutané, rougeur
- bronchospasme exceptionnel
Dépend :
- de la vitesse d'injection (plus la vitesse est élevée, plus d'histamine est libérée)
- de la dose (plus la dose est élevée, plus d'histamine est libérée)
3) Allergie vraie :
Phénomène immunologique : POUR TOUS LES CURARES
- Conflit antigène/anticorps.
- Présence d'anticorps anti ammonium quaternaire (NH4+).
- Indépendant de la dose.
- Possibilité d'allergie croisée avec les produits cosmétiques, conservateurs, savons, lessives. Donc risque de choc anaphylactique grave dès le 1° contact car allergie à cette molécule présente ailleurs (attention aux patients qui se plaignent de ces allergies particulières.
- Possibilité d'allergie croisée avec d'autres curares faire tester le patient.
Signes :
- flush (rush cutané)
- urticaire
- bronchospasme
- cyanose
- tachycardie
- hypoTA
- voire arrêt cardio-ventilatoire
Potentialisation :
- Potentialisation des effets des CND avec les aminosides (ATB) et les halogénés (au bout d'1h30 d'administration...).
- Pour les interventions de longue durée, augmentation de la durée d'action des bolus.
Utilisation pratique des myorelaxants non dépolarisants
But de la curarisation :
- faciliter intubation trachéale (intubation moins délétère au niveau pharyngé)
- relâchement musculaire nécessaire pour la chirurgie : le niveau de bloc dépend de l'intervention chirurgicale
- faciliter ventilation mécanique
- décurarisation rapide à la fin de la chirurgie
Le choix d'un curare dépend de la durée d'action clinique, donc de la durée de la chirurgie.
Selon les CND, il est possible d'augmenter la dose d'intubation pour réduire le temps d'installation, mais effets indésirables +++.
Méthodes d'administration des curares :
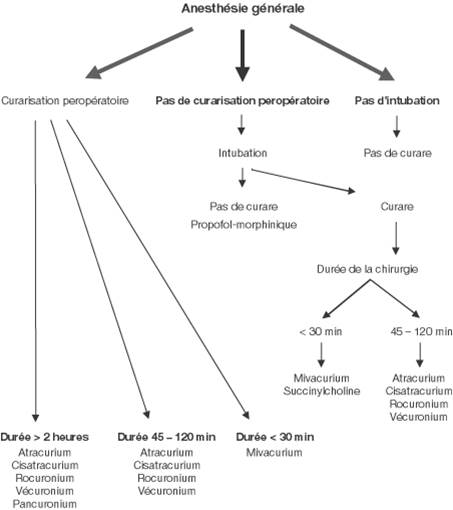
INDUCTION :
- Chirurgie < 30 mn :
- Succinylcholine
- Mivacurium
- Chirurgie de 30 à 120 mn :
- Succinylcholine
- Mivacurium
- Atracurium/Vécuronium/Rocuronium
- Chirurgie de 2 à 4 heures :
- Succinylcholine
- Atracurium/Vécuronium/Rocuronium
- Chirurgie de plus de 4 heures :
- Succinylcholine
- Atracurium/Vécuronium/Rocuronium
- Pancuronium
ENTRETIEN :
- Chirurgie < 30 mn :
- perfusion Mivacurium
- Chirurgie de 30 à 120 mn :
- perfusion Mivacurium
- perfusion ou bolus Atracurium/Vécuronium/Rocuronium
- Chirurgie de plus de 2 heures :
- perfusion ou bolus Atracurium/Vécuronium/Rocuronium
- bolus Pancuronium
- On ne fait plus de Célocurine en perfusion continue.
- Quand ont commence avec un CND, on continue avec le même, sauf pour la Succinylcholine.
| Curares |
Dose entretien (mg/kg) |
Intervalle entre deux dose(mn) |
Débit de perfusion (mg/kg/h) |
|---|---|---|---|
| Mivacurium | 0,1 |
10-15 |
0,5-0,6 |
| Atracurium |
0,1-0,2 |
20-40 |
0,3-0,6 |
| Vécuronium |
0,025 |
20-30 |
0,1 |
| Rocuronium |
0,15 |
15-20 |
0,3-0,5 |
| Cisatracurium |
0,03 |
50-60 |
0,02-0,06 |
| Pancuronium |
0,01-0,03 |
45-60 |
0,02-0,06 |
Antagonisation
La Néostigmine, anticholinestérasique, bloque la dégradation de l'Ach et permet donc d'augmenter sa concentration au niveau de la plaque motrice. Elle se fixe sur l'acétylcholinestérase, l'empêchant de se fixer sur l'Ach.La Néostigmine est non utilisable pour antagoniser les insuffisants rénaux car sa clairance diminue chez eux, comme pour celle des CND (augmentation de la durée d'action de la Néostigmine).
Effets secondaires :
- effets cardio-vasculaires :
- effet parasympathomimétique : grande bradycardie avec arrêt cardiaque par asystolie
- effets gastro-intestinaux :
- augmente le transit intestinal
En pratique :
- utilisation conjointe d'Atropine (l'idéal serait Néostigmine puis atropine car atropine agit plus rapidement).
- Seule CI : coronarien sévère. (Asthme : OK)
Facteurs de variations de l'effet antagoniste :
- type de curare ++
- intensité du bloc ++ (niveau du bloc)
- Interactions médicamenteuses :
- antibiotiques
- halogénés ++
- anesthésique local
- inhibiteur calcique
- Succinylcholine
- équilibre acide-base :
- acidose respiratoire
- alcalose métabolique
- Métabolisme :
- hypokaliémie ++
- hypermagnésiumémie
- hypocalcémie ++
L'antagonisation sert à accélérer une antagonisation en cours. Inutile d'antagoniser un patient profondément curarisé.
Le degré du bloc est un facteur important pour la rapidité de décurarisation. Il faut antagoniser un patient qui commence déjà à récupérer, avec un TOF > 70 %.
Manuel pratique d’anesthésie 3e édition Éric Albrecht
Anticholinestérasiques (inhibiteurs de l'acétylcholinestérase)
■ Les anticholinestérasiques ou inhibiteurs de l'acétylcholinestérase produisent une inhibition réversible de l'acétylcholinestérase, entraînant ainsi la stimulation de la jonction neuromusculaire ; ils sont utilisés en anesthésie pour antagoniser le bloc musculaire induit par les curares non dépolarisants, à l'exception du mivacurium. La néostigmine possède en outre un faible effet agoniste sur la jonction neuromusculaire.
■ Ces médicaments produisent également une inhibition des pseudocholinestérases plasmatiques, et potentialisent l'action des curares dépolarisants et du mivacurium. Leur administration est prohibée lors d'utilisation de suxaméthonium.
■ Les effets systémiques résultent de la stimulation des récepteurs muscariniques du système parasympathique (bradycardie, bronchoconstriction,augmentation des sécrétions bronchiques, lacrymales, salivaires, gastriques et sudoripares, augmentation du péristaltisme intestinal). Ces effets secondaires sont limités par l'administration simultanée d'un anticholinergique (atropine, glycopyrrolate).
Indications
- Antagonisation de la curarisation en fin d'intervention :
- tout patient ayant reçu un curare non dépolarisant doit bénéficier de l'administration d'une dose de « décurarisation », sauf si la réponse T4/T1 au train-de-quatre (voir chapitre 2, « Équipement ») est supérieure à 0,9. En effet, le risque de complications respiratoires (obstruction des voies aériennes supérieures par diminution du tonus des muscles pharyngés dont le génioglosse, hypoxémie, inhalation bronchique) est directement proportionnel à l'état de curarisation résiduelle, défini par un rapport T4/T1 < 0,9 ;
- contrairement au rapport numérique T4/T1 mesuré par accélérométrie (par exemple appareil autonome type TOF watch SX®), l'appréciation visuelle ou tactile du rapport T4/T1 est peu sensible, largement insuffisante pour évaluer le niveau de décurarisation ;
- une antagonisation de la curarisation en fin d'intervention par un anticholinestérasique est justifiée dès l'apparition de deux réponses au train-de-quatre et en l'absence d'une méthode objective de mesure du rapport T4/T1 > 0,9. Si un anticholinestérasique est administré lorsqu'il n'y a aucune réponse ou qu'une seule, le patient peut récupérer quatre réponses au train-de-quatre, sans détection clinique de l'épuisement de la réponse, alors que la levée du bloc n'a pas atteint un niveau de récupération suffisant.
- Myasthénie.
- Vessie atone.
- Iléus paralytique.
- Intoxication à l'atropine (physostigmine).
Contre-indications à une antagonisation de la curarisation
Les contre-indications suivantes sont relatives et les risques doivent être appréciés en regard d'une éventuelle curarisation résiduelle :
■ Asthme et bronchopneumopathie chronique avec composante spastique ;
■ Bronchospasme peropératoire ;
■ Maladie de Parkinson.
Anticholinestérasiques
■ Il existe différents anticholinestérasiques . La néostigmine est l'inhibiteur de l'acétylcholinestérase le plus couramment utilisé en anesthésie.